
| A. | 加热蒸馏 | |
| B. | 利用银镜反应进行分离 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 |
分析 CH3CHO、CH3COOH均溶于水,二者均易挥发,沸点不同,选择蒸馏法分离,为充分分离,可加入碳酸盐,然后加入硫酸,以此来解答.
解答 解:A.均易挥发,直接加热蒸馏不能得到纯净物,故A不选;
B.乙醛发生银镜反应生成乙酸,但银氨溶液呈碱性,生成乙酸铵,引入稀杂质,故B不选;
C.乙酸与碳酸钠反应后,与乙醛混溶,不能萃取分离,故C不选;
D.先加入烧碱溶液,乙酸与NaOH反应增大与乙醛的沸点差异,蒸馏先蒸出乙醛,再加入浓H2SO4,与乙酸钠反应生成乙酸,然后蒸出乙酸,故D选.
故选D.
点评 本题考查物质分离提纯方法的选择和应用,为高频考点,把握物质的性质、性质差异及混合物分离原理为解答的关键,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液的pH值应等于7 | |
| B. | 如果酸是强酸,则pH一定小于7 | |
| C. | 如果碱是强碱,则pH一定不大于7 | |
| D. | 如果混合液的pH大于7,则碱一定为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(B)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 反应前2min的平均速率v(B)=0.15 mol/(L•min) | |
| B. | 保持其他条件不变,升高温度,平衡时c(B)=0.22 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,起始向容器中充入2.0 mol A,反应达到平衡时C的体积分数减小 | |
| D. | 保持其他条件不变,增大该反应体系的压强,平衡左移,反应的平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于d | |
| B. | 若从正反应开始平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 若平衡体系中气体M mol,再充入bmolB,达到平衡气体量为(M+b)mol,则a+b=c+d | |
| D. | 若a+b=d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发易降解的生物农药 | |
| B. | 对燃煤进行脱硫处理 | |
| C. | 对塑料等垃圾进行深埋或倾倒入海处理 | |
| D. | 推广使用节能环保材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
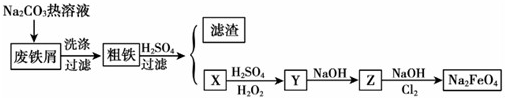
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com