
| A. | 加入少量NaOH固体,电离平衡向正向移动 | |
| B. | 加入少量NaOH固体,溶液中的H+浓度增大 | |
| C. | 加入少量CH3COONa固体,电离平衡向正向移动 | |
| D. | 加入少量CH3COONa固体,溶液中的CH3COO-浓度减小 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期主族元素,原子半径随原子序数增大而增大 | |
| B. | 第3周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 周期表中所含元素种类最多的族是ⅠA族 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、OH- | B. | SO32-、SO42-、H+、K+ | ||
| C. | Fe2+、Fe3+、Cu2+、Cl- | D. | Ba2+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿司匹林课解热镇痛,常用于治疗感冒 | |
| B. | 氢氧化钠能中和胃酸,可用于治疗胃酸过多 | |
| C. | 蚕丝的主要成分是纤维素 | |
| D. | 合金中一定只含金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
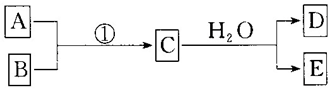
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com