
| A. | Ba( NO3-)2=Ba2++( NO3-) 2 | B. | NaHSO4=Na++H++SO42- | ||
| C. | H2SO4=2H++SO42- | D. | KClO3=K++ClO3- |
分析 A.硝酸钡完全电离生成钡离子和2个硝酸根离子;
B.硫酸氢钠完全电离生成钠离子、氢离子和硫酸根离子;
C.硫酸完全电离生成氢离子和硫酸根离子;
D.氯酸钾完全电离生成钾离子和氯酸根离子.
解答 解:A.硝酸钡完全电离生成钡离子和2个硝酸根离子,电离方程式为Ba( NO3)2=Ba2++2 NO3-,故A错误;
B.硫酸氢钠完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为NaHSO4=Na++H++SO42-,故B正确;
C.硫酸完全电离生成氢离子和硫酸根离子,电离方程式为H2SO4=2H++SO42-,故C正确;
D.氯酸钾完全电离生成钾离子和氯酸根离子,电离方程式为KClO3=K++ClO3-,故D正确;
故选A.
点评 本题考查电离方程式的书写,侧重考查学生分析判断能力,明确电解质强弱及电离出的离子是解本题关键,注意硫酸氢钠在水溶液中和熔融状态下电离方式的不同点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若三种溶液中c(H+)分别为a1 mol•L-1、a2 mol•L-1、a3 mol•L-1,则它们的大小关系为$\frac{1}{2}$a2=a1=a3 | |
| B. | 等体积的以上三种酸分别与过量的NaOH溶液反应,若生成的盐的物质的量依次为b1 mol、b2 mol、b3 mol,则它们的大小关系为b1=b2<b3 | |
| C. | 分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为V1=V2=V3 | |
| D. | 分别与Zn反应,开始时生成H2的速率分别为v1、v2、v3,其大小关系为v2>v1>v3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
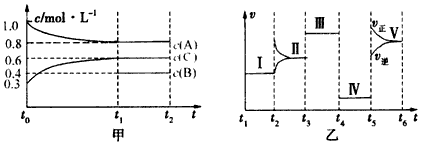
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | NaHSO4?Na++HSO4- | ||
| C. | H2S+H2O?HS-+H3O+ | D. | Ca(OH)2?Ca2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
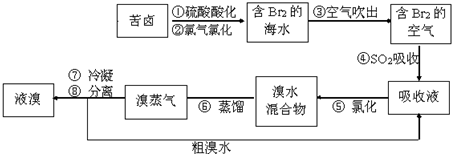
| A. | 步骤④⑤是为了富集溴 | |
| B. | 步骤③说明溴具有挥发性 | |
| C. | 步骤④的离子方程式为Br2+SO2+H2O═2H++2Br-+SO32- | |
| D. | 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com