
 ;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.
;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4. 分析 ①活泼金属与活泼非金属之间形成离子键,非金属之间形成共价键;
②离子晶体熔化时破坏离子键;原子晶体熔化时破坏共价键;分子晶体破坏分子间作用力;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
解答 解:①活泼金属与活泼非金属之间形成离子键,铵根离子与阴离子之间形成离子键,非金属之间形成共价键,则晶体中既有离子键又有共价键的是NH4Cl、Ca(OH)2;
故答案为:NH4Cl、Ca(OH)2;
②P4、CO2属于分子晶体,熔化时破坏分子间作用力,不会破坏化学键;SiO2、金刚石属于原子晶体,熔化时破坏共价键;
故答案为:P4、CO2;SiO2、金刚石;
③二氧化碳的电子式为: ;SiO2属于原子晶体,NaF属于离子晶体,白磷和二氧化碳属于分子晶体,常温下白磷为固体,CO2是气体,则熔点:SiO2>NaF>P4(白磷)>CO2;
;SiO2属于原子晶体,NaF属于离子晶体,白磷和二氧化碳属于分子晶体,常温下白磷为固体,CO2是气体,则熔点:SiO2>NaF>P4(白磷)>CO2;
故答案为: ;SiO2>NaF>P4(白磷).
;SiO2>NaF>P4(白磷).
点评 本题考查了离子键、共价键、物质熔沸点的比较等,明确这几个概念的内涵是解本题关键,注意这几个概念的区别,注意不能根据是否含有金属元素判断离子键,如铵盐,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是吸热反应 | B. | 是放热反应 | ||
| C. | 是熵减小的反应 | D. | 熵增大效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: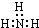 | B. | S2-的结构示意图: | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
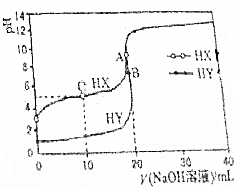 25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的盐酸和醋酸溶液的滴定曲线如图所示(混合溶液体积变化忽略不计).下列说法不正确的是( )| A. | 根据滴定曲线,可得Ka(CH3COOH)≈10-5 | |
| B. | pH=7时,滴定醋酸溶液消耗的V(NaOH溶液)<20mL | |
| C. | C点溶液:c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当V(NaOH溶液)=20mL时,A点水电离出c(H+)大于B点水电离出的c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3与氢碘酸溶液反应Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 电解MgCl2溶液Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2 | |
| C. | Zn与氯化铵溶液反应生成气体Zn+2NH4+═Zn2++4H2↑+N2↑ | |
| D. | 向明矾的水溶液中滴加足量Ba(OH)2溶液Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com