
| A£® | ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³æÉÄę·“Ó¦µÄ”÷H=+100kJ•mol-1£¬ŌņøĆ·“Ó¦Õż·“Ó¦»ī»ÆÄܱČÄę·“Ó¦»ī»ÆÄÜ“ó100kJ•mol-1 | |||||||||
| B£® | H2£Øg£©+Br2£Øg£©ØT2HBr£Øg£©”÷H=-72kJ•mol-1ĘäĖüĻą¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
| |||||||||
| C£® | ŌŚøō¾ųæÕĘųĻĀ£¬9.6gĮņ·ŪÓė11.2gĢś·Ū»ģŗĻ¼ÓČČÉś³ÉĮņ»ÆŃĒĢś17.6 gŹ±£¬·Å³ö19.12 kJČČĮ森ŌņČČ»Æѧ·½³ĢŹ½ĪŖFe£Øs£©+S£Øs£©ØTFeS£Øs£©£»”÷H=-95.6 kJ•mol-1 | |||||||||
| D£® | Čō2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H=-483.6 kJ•mol-1£¬ŌņH2Č¼ÉÕČČĪŖ-241.8 kJ•mol-1 |
·ÖĪö A£®ŅĄ¾ŻÕż·“Ó¦ŗĶÄę·“Ó¦µÄ»ī»ÆÄÜ·ÖĪöÅŠ¶Ļ£»
B£®øł¾Ż·“Ó¦ČČ=·“Ó¦Īļ¼üÄÜÖ®ŗĶ-Éś³ÉĪļ¼üÄÜÖ®ŗĶ¼ĘĖć£»
C£®øł¾Ż²Ī¼Ó·“Ó¦µÄĪļÖŹµÄĮæ¼ĘĖć·“Ó¦ČČ£»
D£®Č¼ÉÕČČŹĒ1molæÉČ¼ĪļĶźČ«Č¼ÉÕÉś³ÉĪȶØŃõ»ÆĪļ·Å³öµÄČČĮ森
½ā“š ½ā£ŗA£®ÕżÄę·“Ó¦µÄ»ī»ÆÄÜÖ®²ī¼“ĪŖøĆ·“Ó¦µÄģŹ±äŹżÖµ£¬ŌŚŅ»¶ØĢõ¼žĻĀ£¬Ä³æÉÄę·“Ó¦µÄ”÷H=+100kJ•mol-1£¬ŌņøĆ·“Ó¦Õż·“Ó¦»ī»ÆÄܱČÄę·“Ó¦»ī»ÆÄÜ“ó100kJ•mol-1£¬¹ŹAÕżČ·£»
B£®·“Ó¦ČČ=·“Ó¦Īļ¼üÄÜÖ®ŗĶ-Éś³ÉĪļ¼üÄÜÖ®ŗĶ£¬ĖłŅŌ”÷H=-72=436+a-2”Į369£¬½āµĆa=230£¬¹ŹBÕżČ·£»
C£®n£ØS£©=$\frac{9.6g}{32g/mol}$=0.3mol£¬n£ØFe£©=$\frac{11.2g}{56g/mol}$=0.2mol£¬ŅŃÖŖFe+S$\frac{\underline{\;\;”÷\;\;}}{\;}$FeS£¬ĖłŅŌFeµÄĮæ²»×ć£¬°“ÕÕFe¼ĘĖć£¬$\frac{0.2mol}{19.12kJ}$=$\frac{1mol}{Q}$£¬ĖłŅŌ1molFe·“Ó¦·Å³öČČĮæĪŖ£ŗ95.6 kJ£¬ĖłŅŌČČ»Æѧ·½³ĢŹ½ĪŖ£ŗFe£Øs£©+S£Øs£©=FeS£Øs£©”÷H=-95.6 kJ•mol-1£¬¹ŹCÕżČ·£»
D£®Č¼ÉÕČČŹĒ1molæÉČ¼ĪļĶźČ«Č¼ÉÕÉś³ÉĪȶØŃõ»ÆĪļ·Å³öµÄČČĮ棬·“Ó¦ÖŠĖ®µÄדĢ¬ĪŖĘųĢ¬£¬²»ŹĒĪȶØŃõ»ÆĪļ£¬ĖłŅŌ·“Ó¦ČČ²»ŹĒČ¼ÉÕČČ£¬¹ŹD“ķĪó£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·“Ó¦ÄÜĮæ±ä»Æ£¬ĢāÄæÉę¼°ČČ»Æѧ·½³ĢŹ½ŹéŠ“”¢Č¼ÉÕČČøÅÄī·ÖĪöÅŠ¶Ļ”¢·“Ó¦ČČµÄ¼ĘĖć£¬ÕĘĪÕČ¼ÉÕČȵÄøÅÄīŹĒ¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 50mL 1 mol•L-1 NaClČÜŅŗ | B£® | 100mL2 mol•L-1 AlCl3ČÜŅŗ | ||
| C£® | 100mL1 mol•L-1 NH4ClČÜŅŗ | D£® | 150mL2 mol•L-1 KClČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĢśøśĻ”ĮņĖį·“Ó¦£ŗ2Fe+6H+ØT2Fe3++3H2”ü | |
| B£® | Ģ¼ĖįøĘČÜŅŗøśŃĪĖį·“Ó¦£ŗCaCO3+2H+ØTCa2++H2O+CO2”ü | |
| C£® | ŃĪĖįøśĒāŃõ»ÆĆ¾ČÜŅŗ·“Ó¦£ŗH++OH-ØTH2O | |
| D£® | ĒāŃõ»Æ±µøśĮņĖįĶ·“Ó¦£ŗBa2++SO42-ØTBaSO4”ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
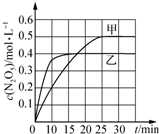 ³ōŃõŹĒĄķĻėµÄŃĢĘųĶŃĻõ¼Į£¬ĘäĶŃĻõ·“Ó¦ĪŖ£ŗ2NO2£Øg£©+O3£Øg£©?N2O5£Øg£©Ź®O2£Øg£©”÷H£®²»Ķ¬ĪĀ¶ČĻĀ£¬ŌŚČżøöČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬Ļą¹ŲŠÅĻ¢Čē±ķ¼°Ķ¼ĖłŹ¾£ŗ
³ōŃõŹĒĄķĻėµÄŃĢĘųĶŃĻõ¼Į£¬ĘäĶŃĻõ·“Ó¦ĪŖ£ŗ2NO2£Øg£©+O3£Øg£©?N2O5£Øg£©Ź®O2£Øg£©”÷H£®²»Ķ¬ĪĀ¶ČĻĀ£¬ŌŚČżøöČŻĘ÷ÖŠ·¢ÉśÉĻŹö·“Ó¦£¬Ļą¹ŲŠÅĻ¢Čē±ķ¼°Ķ¼ĖłŹ¾£ŗ| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ČŻ»ż/L | 1 | 1 | 2 |
| ·“Ó¦Īļ | |||
| ĘšŹ¼Įæ | 2mol NO2 | ||
| 1mol O3 | 2mol NO2 | ||
| 1mol O3 | 2mol N2O5 | ||
| 1mol O2 | |||
| ĪĀ¶Č/K | T1 | T2 | T2 |
| A£® | 0”«10 minÄŚ¼×ČŻĘ÷ÖŠ·“Ó¦µÄĘ½¾łĖŁĀŹ£ŗv£ØNO2£©=0.02 mol•L-1•min-1 | |
| B£® | T1£¼T2£¬”÷H£¾0 | |
| C£® | Ę½ŗāŹ±N2O5ÅØ¶Č£ŗcŅŅ£ØN2O5£©£¾c±ū£ØN2O5£© | |
| D£® | T1KŹ±£¬ČōĘšŹ¼Ź±ĻņČŻĘ÷¼×ÖŠ³äČė2 mol NO2”¢1 mol O3”¢2 mol N2O5ŗĶ2 mol O2£¬ŌņĶŃĻõ·“Ó¦“ļµ½Ę½ŗāĒ°£¬v£ØÕż£©£¼v£ØÄę£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ·“Ó¦Ź±¼ä/min | n£ØCO£©/mol | n £ØH2O£©/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
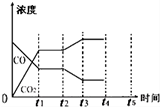
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
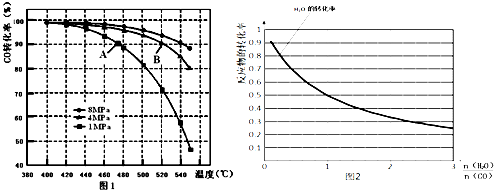
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 2013Äź12ŌĀ17ČÕ£¬ÖŠ¹ś¹śĶĮ׏Ō“²æÕŁæŖŠĀĪÅ·¢²¼»į£¬Šū²¼ŌŚ¹ć¶«ŃŲŗ£Öé½æŚÅčµŲ¶«²æŗ£ÓņŹ×“Īן»ńøß“æ¶ČæÉČ¼±ł£®æÉČ¼±łµÄÖ÷ŅŖ³É·ÖŹĒ¼×Ķ飬¼×Ķé¼ČŹĒĒå½ąµÄČ¼ĮĻ£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®
2013Äź12ŌĀ17ČÕ£¬ÖŠ¹ś¹śĶĮ׏Ō“²æÕŁæŖŠĀĪÅ·¢²¼»į£¬Šū²¼ŌŚ¹ć¶«ŃŲŗ£Öé½æŚÅčµŲ¶«²æŗ£ÓņŹ×“Īן»ńøß“æ¶ČæÉČ¼±ł£®æÉČ¼±łµÄÖ÷ŅŖ³É·ÖŹĒ¼×Ķ飬¼×Ķé¼ČŹĒĒå½ąµÄČ¼ĮĻ£¬Ņ²ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£®| ĪļÖŹ | H2 | CO | CH3OH |
| ÅضČ/£Ømol•L-1£© | 0.20 | 0.10 | 0.40 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| A | B | C | |
| D | E | F |
 £¬ŹµŃéŹŅÖĘČ”ĘųĢå¼×µÄ»Æѧ·½³ĢŹ½ĪŖ2NH4Cl+Ca£ØOH£©2$\frac{\underline{\;\;”÷\;\;}}{\;}$CaCl2+2NH3”ü+2H2O£®
£¬ŹµŃéŹŅÖĘČ”ĘųĢå¼×µÄ»Æѧ·½³ĢŹ½ĪŖ2NH4Cl+Ca£ØOH£©2$\frac{\underline{\;\;”÷\;\;}}{\;}$CaCl2+2NH3”ü+2H2O£® £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com