
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
; ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+分析 ①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素,据此解答.
解答 解:①②⑧最高正价为+1,为第IA族元素,原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;③只有-2价,没有正化合价,为第VIA族元素,则③是O元素;④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,最容易失去电子,F2氧化性最强,与H2最容易化合,故答案为:②;氟气;
(2)元素⑤的氢化物为CH4,结构式为 ,③和⑤形成的化合物为CO2等,电子式为
,③和⑤形成的化合物为CO2等,电子式为 等,元素③和⑧形成的既有离子键,又有共价键的化合物为Na2O2,电子式为
等,元素③和⑧形成的既有离子键,又有共价键的化合物为Na2O2,电子式为 ,
,
故答案为: ;
; ;
; ;
;
(3)某元素R的原子半径为1.02×10-10m,原子半径介于Cl、P之间,故为S元素,该元素在周期表中的位置是:第三周期第ⅥA族,它的阴离子结构示意图为 ,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2->K+,
,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2->K+,
故答案为:第三周期第ⅥA族; ;S2->K+;
;S2->K+;
(4)⑥、⑦元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质是PCl3,故答案为:PCl3;
某元素R的原子半径为1.02×10-10m,原子半径介于Cl、P之间,故为S元素,该元素在周期表中的位置是:第三周期第ⅥA族;
故答案为:CCl4、PCl3;第三周期第ⅥA族;
(5)④最高价氧化物对应水化物为Al(OH)3,⑦和⑧的最高价氧化物的水化物反应分别为HClO4、NaOH,氢氧化铝与高氯酸、氢氧化钠反应的离子方程式为:3H++Al(OH)3=Al3++3H2O、OH-+Al(OH)3=AlO2-+2H2O,
故答案为:3H++Al(OH)3=Al3++3H2O、OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:解答题
 电化学在生产、生活中具有广泛的应用.
电化学在生产、生活中具有广泛的应用.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧转变为氧气 | |
| B. | 工业生产中氯化钠晶体的熔化、冷却 | |
| C. | 夏天马路洒水降温 | |
| D. | 日本大地震中用次氯酸溶液进行环境消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
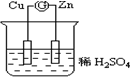 如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.
如图所示的原电池装置中,锌为负极,电极发生的是氧化反应(填氧化或还原),电极反应式为Zn-2e-=Zn2+;铜电极反应式为2H++2e-=H2↑,铜片上观察到的现象为有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com