
【题目】胶体区别于其它分散系的本质特征是
A.胶体分散质粒子直径介于1nm~100nm之间B.胶体能产生丁达尔现象
C.胶体是一种澄清透明的分散系D.胶体可用于净水
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1=206.1kJmol﹣1
②CH4(g)+CO2(g)2CO(g)+2H2(g)△H2=247.3kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . 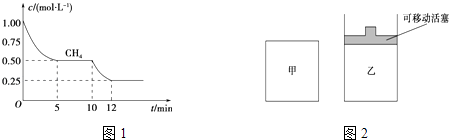
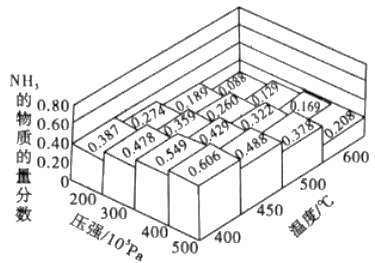
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变. ①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)反应③中△H3= kJmol﹣1 . 800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准NaOH溶液滴定充满HCl的烧瓶(标况下)做完喷泉实验后得到的稀盐酸,以测定它的准确浓度,请你回答下列问题:
(1)理论计算该盐酸的物质的量浓度为:________________________________。
(2)若用甲基橙作指示剂,达到满定终点时的现象是___________________________。
(3)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第__________种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
(4)若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=___________________。
(5)在滴定操作过程中,以下各项操作使测定值偏高的有:_______________
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:其中正确的是( ) ①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质B的浓度为0.7molL﹣1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料。
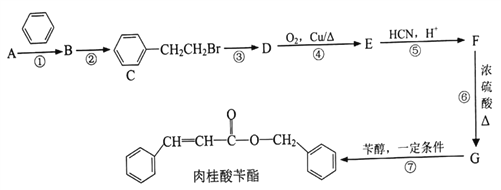
(1)不同温度、压强下.合成该平衡体系NH3的物质的量分数如图 (N2和H2的起始物质的量之比为1:3)。
①分析图中数据,升高温度,该反应的平衡常数K值____(填“增大”“减小”或“不变”)。
②如果开始时向密闭容器中投入1.0mol N2 和3.0mol H2,则在500℃、3×107Pa条件下达到平衡时N2 的平衡转化率=_______。(保留两位有效数字)
③液氨和水颇为相像,它能溶解多种无机及有机分子,其电离方程式可表示为2NH3 ![]() NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
NH4++ NH2一(某温度下其离子积常数为10-30)。液氨中的pNH4与水中的pH相似,则该温度下液氨的pNH4=____。
(2)以氨气代替氢气研发氨清洁燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液。该电池负极的电极反应式为_________________。
(3)NH3也是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应I: NH3 (aq)+HClO(aq)=NH2Cl(aq)+H2O(l) △H1=akJ/mol;
反应II :NH2Cl(aq)+HClO(aq)=NHCl2(aq) +H2O(l) △H2=bkJ/mol;
反应III: 2NHCl2(aq) +H2O(l)=N2(g)+HClO( aq)+3HCl( aq) △H3=ckJ/mol。
①2NH3(aq)+3HClO(aq)==N2 (g)+3HCl(aq)+3H2O(l) △H=________kJ/mol
②已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件不变的情况下,改变![]() 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量)的影响如图所示。a点之前溶液中发生的主要反应为_______(填序号)。
A.反应I、I I B.反应I

③除氨氮过程中最佳的![]() 值约为______________。
值约为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
肉桂酸苄酯又名苯丙烯酸苄酯,常作为定香剂,也可用于香皂及食品香精的调香原料。以下是一种合成肉桂酸苄酯的路线。
已知:I.相同条件下,烃A对氢气的相对密度为13
Ⅱ.反应①、反应②的原子利用率均为100%
III.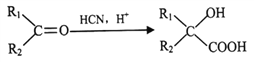
![]()
回答下列问题:
(1)A的名称为____________________。
(2)反应③的条件为____________________。
(3)上述合成路线涉及的反应中,属于取代反应的有___________________〔填编号)。
(4)写出反应D→E的化学方程式__________________________________。
(5)写出G在一定条件下生成的高分子化合物的结构简式__________________。
(6)F同时满足下列条件的同分异构体共有__________种(不考虑立体异构)。
①苯环上有2个取代基
②能发生银镜反应和水解反应
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示6组峰,且峰面积比为3:2:2:1:1:1的是___________(填结构简式)
(7)参照上述合成路线,以CH3CHO为原料,设计制备![]() 的合成线路(无机试剂及溶剂任选) __________________。
的合成线路(无机试剂及溶剂任选) __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com