
分析 (1)维生素C具有较强的还原性,易被氧化,煮沸是为了除去溶液中溶液的O2,冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速度;
(2)计算滴定过程中消耗碘单质的物质的量,再根据方程式C6H8O6+I2→C6H6O6+2HI计算样品中维生素C的物质的量,进而计算质量分数.
解答 解:(1)由于维生素C具有较强的还原性,易被氧化,煮沸是为了除去溶液中溶液的O2,避免维生素C被O2氧化,冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速度,
答:煮沸是为了除去溶液中溶液的O2,避免维生素C被O2氧化,冷却是为了减缓滴定过程中维生素C与液面上空气接触时被氧化的速度;
(2)滴定过程中消耗碘单质的物质的量=0.021 L×0.05mol/L,根据方程式C6H8O6+I2→C6H6O6+2HI可知,
样品中维生素C的物质的量=n(I2)=0.021 L×0.05mol/L,
则样品中维生素C的质量分数=$\frac{0.021L×0.05mol/L×176g/mol}{0.2g}$×100%=92.4%,
答:样品中维生素C的质量分数为92.4%.
点评 本题滴定为载体考查根据方程式计算等,难度不大,(1)中注意对信息的提取及根据温度对反应速率的影响解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:Y>X | |
| D. | X、Z可形成化学式为Z2X和Z2X2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
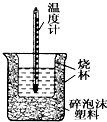 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g乙烯和28g丙烯中均含有6NA对共用电子对 | |
| B. | 标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA | |
| C. | 标准状况下,560 mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.2NA | |
| D. | 11.2L乙烯、乙炔的混合物中C原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com