
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A.A的平均反应速率是0.010mol·L-1·s-1
B.容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比—定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.3mol
【答案】B
【解析】
试题分析: 依据化学平衡的三段式列式;半分钟后,C的物质的量增加了0.30mol;
4A(g)+5B(g)═4C(g)+6D(g)
起始量(mol) x y 0 0
变化量(mol) 0.3 0.375 0.3 0.45
平衡量(mol) x-0.3 y-0.375 0.3 0.45
A、A的平均反应速率= 0.3/5/30=0.0020 molL-1s-1,A错误;
B、起始量不定,容器中含D物质的量至少为0.45 mol,B正确;
C、起始量不知,容器中A、B、C、D的物质的量的比不一定是4:5:4:6,故C错误;
D、容器中A的物质的量一定减少了0.30 mol,故D错误;


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)反应②是________________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
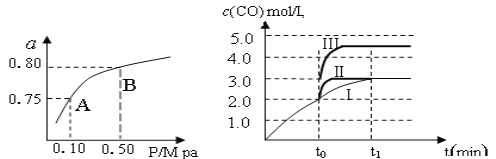
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________________。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
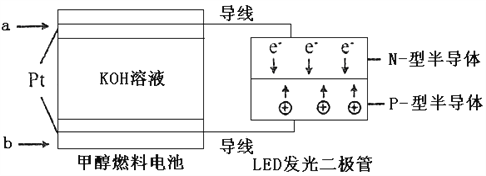
请写出加入(通入)b物质一极的电极反应式_________________;
每消耗6.4g甲醇转移的电子数为_______________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断( )
A.R可能是第二周期元素
B.R一定是ⅥA族元素
C.R的气态氢化物比同周期其它元素气态氢化物稳定
D.R的气态氢化物化学式为H2R.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪位科学家最先发现了电子( )
A.Joseph John Thomson
B.Ernest Rutherford
C.Justus von Liebig
D.Jons Jakob Berzelius
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A. sp,范德华力 B. sp2,范德华力
C. sp2,氢键 D. sp3,氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y 原子最外层电子数是次外层电子数的2倍:Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1) 元素X原子结构示意图为_________________。
(2) 元素Y的一种同位素可测定文物年代,这种同位素的符号是______________。
(3) 元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为_________________________。
(4) ZW3可与水反应生成一种酸和一种碱,反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙炔制取的说法不正确的是( )
A. 为了加快反应速率可用饱和食盐水代替水
B. 此反应是放热反应
C. 为了除去H2S杂质气体,可用氢氧化钠溶液洗气
D. 反应中不需加碎瓷片作沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如图所示工艺流程:

请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是____________(填操作名称),此操作需要用到的玻璃仪器____________、_____________、____________。
(2)沉淀B的成分是_________(填化学式,下同),沉淀C的成分是____________;
(3)写出生成溶液D的离子方程式______________________;
(4)物质M转化为铝的化学方程式为______________________;溶液D中通入过量CO 2生成沉淀F的离子方程式为______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com