
| 102×9.8% |
| 1 |
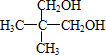 ,反应为
,反应为 →
→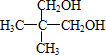 ,则A为
,则A为 ,据此解答.
,据此解答.| 102×9.8% |
| 1 |
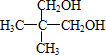 ,反应为
,反应为 →
→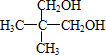 ,则A为
,则A为 .
.| y |
| 4 |
| z |
| 2 |
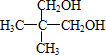 ,故答案为:
,故答案为: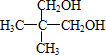 ;
; ,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,发生还原反应,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,故选B;
,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,发生还原反应,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,故选B;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.1mol/L的氨水可使酚酞试液变红 |
| B、0.1mol/L的氯化铵溶液的pH约为5 |
| C、在相同条件下,氨水溶液的导电性比强碱溶液弱 |
| D、铵盐受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )
将物质的量浓度相等的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液的pH随时间t变化的曲线如图所示,则下列说法中不正确的是( )| A、A点pH小于7是因为Cu2+水解使溶液显酸性 |
| B、BC段阳极产物是Cl2 |
| C、整个过程中阳极先产生Cl2,后产生O2 |
| D、CD段电解的物质是水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备氢氧化铝,用铝盐和过量的氨水:Al3++3OH-=Al(OH)3↓ | ||||
| B、漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2=CaSO3↓+2HClO | ||||
C、铁粉和水蒸气反应:2Fe+3H2O(g)
| ||||
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其溶液的pH=13 |
| B、加入少量NaOH,溶液中c(NH4+)减小,Kw减小 |
| C、与AlCl3溶液反应的离子方程式为Al3++3OH-=Al(OH)3↓ |
| D、滴加0.10mol?L-1 HNO3溶液到pH=7,溶液中离子浓度关系为:c(NO3-)=c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com