
|
1 mol CO2和36.5 g HCl气体的体积,前者与后者的关系是 | |
| [ ] | |
A. |
大于 |
B. |
小于 |
C. |
等于 |
D. |
不能确定 |
科目:高中化学 来源:湖南省浏阳一中2011-2012学年高二第一次阶段性考试化学试题 题型:022
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1和-726.5 kJ·mol-1.请回答下列问题:
(1)用太阳能分解5 mol水消耗的能量是________kJ;
(2)ΔH表示甲醇燃烧热的热化学方程式为:________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
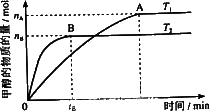
下列说法正确的是________(填序号)
①温度为T2时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nB/tB mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的大
③该反应为吸热反应
④该反应为熵增加的反应
(4)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若容器内的压强与起始压强之比为0.8,则平衡时甲醇的体积分数为________;
查看答案和解析>>
科目:高中化学 来源:山东省济南市重点中学2010-2011学年高二下学期期末考试化学试题 题型:022
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.
(1)地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以描述分为下列三步(用“C5”表示C5H10O4,用“C3”表示C3H6O3):
Ⅰ、H2O(l)=2H+(aq)+1/2O2(g)+2e- ΔH=+284 kJ/mol
Ⅱ、CO2(g)+C5(s)+2H+(aq)=2C3+(s) ΔH=+396 kJ/mol
Ⅲ、12C3+(s)+12e-=C6H12O6(葡萄糖、s)+6C5(s)+3O2(g) ΔH=-1200 kJ/mol
写出绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式________.
(2)有效地开发利用CO2可以降低大气中CO2的含量,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
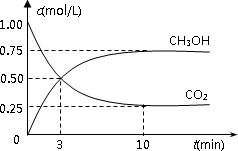
①从反应开始到平衡,氢气的平均反应速率
v(H2)=________mol/(L·min);②CO2的转化率=________;
③该反应的平衡常数为________(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化学 来源:黑龙江省鹤岗一中2010-2011学年高一下学期期末考试化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:江苏省启东中学2012届高三第二次月考化学试题 题型:058
为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如下:
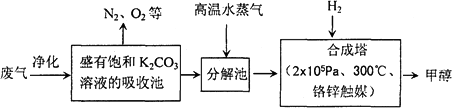
(1)合成塔中反应的化学方程式为________;ΔH<0.该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了________.
(2)从合成塔分离出甲醇的原理与下列________操作的原理比较相符(填字母)
A.过滤
B.分液
C.蒸馏
D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施.“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括________.
(3)一定条件下
,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是________.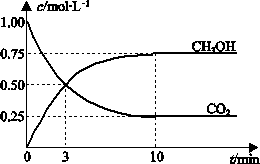
A.升高温度能使![]() 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min
时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率D.
从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1(4)如将CO2与H2以1∶4的体积比混合,在适当的条件下可制得CH4.
已知CH4(g)+2O2(g)![]() CO2(g)+2H2O(1)ΔH1=-890.3 kJ/mol
CO2(g)+2H2O(1)ΔH1=-890.3 kJ/mol
H2(g)+![]() O2(g)
O2(g)![]() H2O(l)ΔH2=-285.8 kJ/mol
H2O(l)ΔH2=-285.8 kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com