
 卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在. ,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.分析 (1)Ca是20号元素,四个电子层,最外层2个电子,所以Ca位于第四周期,第ⅡA族,是s区元素;
(2)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(3)同一周期中,元素的电负性随着原子序数的增大而增大;
(4)分子组成类似的分子化合物,相对分子质量越大,沸点越高,但是由于HF存在氢键,故沸点比HI要高;非金属性越强对应氢化物越稳定,据此解答;
(5)原子个数相等、价电子数相等的微粒为等电子体;1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化;
(6)a.阴阳离子间存在静电引力和静电斥力,则;
b.离子晶体的熔点与离子所带电荷、离子半径有关;
c.晶体的结构与电荷比、半径比有关;
d.离子化合物在熔融时能发生电离;
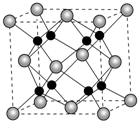
e.该晶胞中灰色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数为8,根据其化学式知,灰色球表示钙离子、黑色球表示氟离子,在同一个晶胞中每个面心上的灰色球连接4个黑色球,每个面心上灰色球连接两个晶胞,所以每个钙离子(灰色球)连接8个氟离子(黑色球),所以钙离子配位数是8.
解答 解:(1)Ca是20号元素,四个电子层,最外层2个电子,所以Ca位于第四周期,第ⅡA族,是s区元素,故答案为:四;ⅡA; s;
(2)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(3)同一周期中,元素的电负性随着原子序数的增大而增大,所以N、O、F、Ca四种元素电负性从大到小的顺序是F>O>N>Ca,故答案为:F>O>N>Ca;
(4)相对分子质量越大,沸点越高,但是由于HF存在氢键,故沸点比HI要高,故沸点顺序为:HF>HI>HBr>HCl,非金属性:F>Cl>Br>I,所以对应氢化物稳定性为:HF>HCl>HBr>HI,故答案为:HF>HI>HBr>HCl; HF>HCl>HBr>HI;
(5)与HF互为等电子体的一种阴离子是氢氧根离子,氢氧根离子的电子式为: ,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为:
,1molNH4NO3中含有4mol氮氢σ键和3mol氧氮σ键,所以含有σ键数目为7mol,其中阳离子铵根离子是sp3杂化,阴离子硝酸根离子中的氮是 sp2杂化,故答案为: ;7mol(或7×6.02×1023); sp2、sp3;
;7mol(或7×6.02×1023); sp2、sp3;
(6)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
e.该晶胞中灰色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球个数为8,根据其化学式知,灰色球表示钙离子、黑色球表示氟离子,在同一个晶胞中每个面心上的灰色球连接4个黑色球,每个面心上灰色球连接两个晶胞,所以每个钙离子(灰色球)连接8个氟离子(黑色球),所以钙离子配位数是8,所以晶胞中Ca2+的配位数与Ca2+个数比为2:1,故答案为:bde.
点评 本题考查了物质结构与性质,题目涉及晶体熔沸点的比较、化学键、杂化理论的应用等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 9% | C. | 14.3% | D. | 17.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、CO32-、SO42- | B. | NO3- | ||
| C. | SO32-、NO3- | D. | CO32-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由原子的质量数决定 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次减弱 | |
| C. | 第三周期非金属元素所形成的所有含氧酸的酸性从左到右一定依次增强 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com