
| A. | 8,18,32,32 | B. | 8,18,18,32 | C. | 8,18,18,18 | D. | 8,8,18,18 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在紫外线、饱和Na2SO4、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 油脂属于高分子化合物,是混合物 | |
| C. | 在一定条件下,氨基酸之间能发生反应,合成更加复杂的化合物 | |
| D. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热,观察是否有砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| A. | K+一定存在,且c(K+)≤1.3mol•L-1 | |
| B. | 实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+ | |
| C. | 实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓ | |
| D. | 实验III能确定一定不存在SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
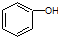 和
和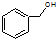
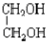 与
与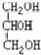
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2(CO):气体通过灼热的CuO | |
| B. | Cl2(SO2):通入盛有品红溶液的洗气瓶 | |
| C. | NO(NO2):通过水洗,再干燥后,用向下排空气法收集 | |
| D. | H2(CO2):依次通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
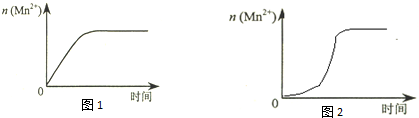
| 编号 | H2O2溶液 | 酸性KMnO4溶液 | 温度/℃ | 再向试管中加入少量固体 | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | |||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com