
| A. | 2:3 | B. | 1:3 | C. | 1:4 | D. | 2:5 |
科目:高中化学 来源: 题型:解答题
| C)°密度(20 | 熔点 | 沸点 | 熔解性 | |
| A | 0.713 7g•cm3- | C°-116.3 | C°34.5 | 不溶于水 |
| B | 0.789 3g•cm3- | C°-117.3 | C°78.5 | 与水以任意比混溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
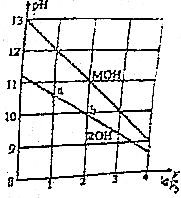 0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )
0.1mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV/V0的变化如图所示,下列叙述错误的是( )| A. | ROH的电离方程式为ROH═R++OH- | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 等pH的ROH和MOH溶液,则MOH的浓度低 | |
| D. | 当1gV/V0=2时,若两溶液同时升高温度,则C(R+)增大,C(M+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳极的离子 和电极反应式 | 阴极的离子 和电极反应式 | 电解总反应式 | 溶液浓度变化 | 溶液pH的变化 | |
| HCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | 减小 | 增大 |
| CuBr2 | 2Br--2e-=Br2 | Cu2++2e-=Cu | 2Br-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Br2+Cu | 减小 | 增大 |
| KCl | 2Cl--2e-=Cl2↑ | 2H++2e-=H2↑ | 2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | 减小 | 增大 |
| CuSO4 | 4OH--4e-=O2↑+2H2O | Cu2++2e-=Cu | 2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | 减小 | 增大 |
| NaOH | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 增大 |
| H2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 减小 |
| KNO3 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
| Na2SO4 | 4OH--4e-=O2↑+2H2O | 2H++2e-=H2↑ | 2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑ | 增大 | 不变 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上适应性考试二化学试卷(解析版) 题型:选择题
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为2mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加3.4g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为5.6g
B.参加反应的硝酸的物质的量为0.2mol
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.标况下产物NO体积为4.48L
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
物质的量之比为2:5的锌和稀硝酸反应若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B. 1:5 C. 2:3 D. 2:5,
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期期中化学试卷(解析版) 题型:实验题
氯、铁的某些化合物在工业生产和生活中有着重要的作用。
(1)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。主要有两种制备方法:
方法一:
工业上常常用 KClO3和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式 ,生成5molClO2转移电子 mol。
方法二:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

NCl3溶液和NaClO2溶液发生反应的离子方程式 。
X中大量存在的阴离子有_____  。
。
(2)铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2 ]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

①检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
②在溶液Ⅰ中加入NaClO3写 出其氧化
出其氧化 Fe2+的离子方程式: 。
Fe2+的离子方程式: 。
③Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平化学方程式:
□Fe2O3+□KNO3+□KOH——□ +□KNO2+□ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com