
【题目】为证明醋酸是弱电解质,下列方法不正确的是( )
A.比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积
B.将1mLpH=3的醋酸溶液稀释到100mL,测其pH小于5
C.比较浓度均为0.1mol·L-1盐酸和醋酸溶液的导电能力
D.测定0.1mol·L-1醋酸溶液的PH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。已知:①KClO在较高温度下发生歧化反应生成KClO3;
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为___。
(2)反应时需将C装置置于冷水浴中,其原因为__。
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是__,制备K2FeO4的离子方程式:___。
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称___,其反应原理为___(用离子方程式表示)。
(5)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00gK2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,
装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
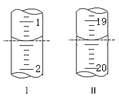
①消耗Na2S2O3标准溶液的体积为___mL。
②原样品中高铁酸钾的质量分数为__。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①一种二肽的结构简式为: ,合成这种二肽的氨基酸是___和___;
,合成这种二肽的氨基酸是___和___;
②生活中有大量的铝制品。家用铝锅不能用热碱水洗涤去污,原因是(用离子方程式表示)____;
③大量使用塑料制品产生的污染称之为_____,防治该污染的有效措施之一是进行回收利用,将回收后的塑料进行____,可以获得乙烯、丙烯等化工原料;
④传统生产水泥的原料中除了石灰石、粘土外,还经常添加____,以调节水泥的硬化速度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
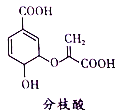
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下物质间转化均能实现的是
A.MnO2![]() Cl2
Cl2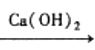 漂白粉
漂白粉
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.S(s) 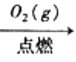 SO3(g)
SO3(g) ![]() H2SO4
H2SO4
D.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3 ![]() Fe(OH)3
Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )
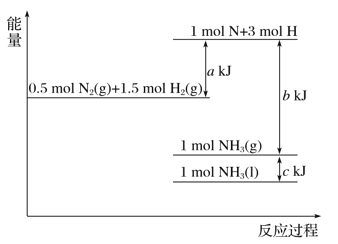
A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化和液化是现代能源工业中重点考虑的综合利用技术。最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-90.8 kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-412 kJmol-1
③CO(g)+2H2(g)CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度
B.增大压强
C.降低温度
D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2 mol H-H键,同时生成3mol C-H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1mol CO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:
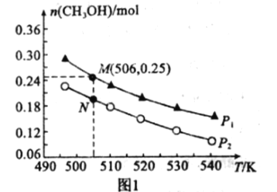
(1)压强P1______P2(填“>”、“<“或”=”)。
(2)M、N两点的化学反应速率:vM______vN(填“>”、“<“或“=”)
(3)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5 MPa)。
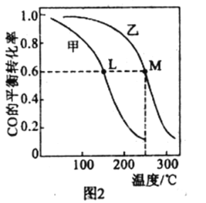
(4)甲、乙两个恒容密闭容器的体积相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)______2P(L),平衡常数:K(M)______K(L)(填“>”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A、B、C和D互为同分异构体,分子量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明:化合物A、B、C和D均是一取代芳香化合物,其中A、C和D的芳环侧链上只含一个官能团。4个化合物在碱性条件下可以进行如下反应:
A![]() E(C7H6O2)+F
E(C7H6O2)+F
B![]() G(C7H8O)+H
G(C7H8O)+H
C![]() I(芳香化合物)+J
I(芳香化合物)+J
D![]() K+H2O
K+H2O
请回答下列问题:
(1)写出A、B、C和D的分子式:__,C的结构简式:__,写出H分子中官能团的名称:__。
(3)按要求写出下列化学反应方程式及反应类型:
①E和G反应:__,反应类型__。
②I和浓溴水反应:___。
(4)A的同分异构体有多种,写出符合下列条件的A的所有同分异构体的结构简式__。
①遇FeCl3溶液显紫色;②可发生银镜反应;③苯环上仅含两个支链。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员借助太阳能,将H2S转化为可再利用的S和H2的工作原理如图所示。下列叙述错误的是( )
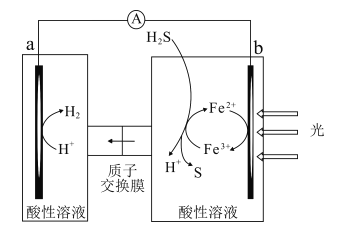
A.该电池能实现将光能转化为化学能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com