
工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s) + CO32—(aq) 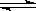 PbCO3(s) + SO42—(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
PbCO3(s) + SO42—(aq) K = 2.2×105。 经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
D. 整个过程涉及一个复分解反应和两个氧化还原反应
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ;②NO2生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省定西市通渭县高三上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.用铜电极电解硝酸银溶液:4Ag++2H2O 4Ag+O2↑+4H+
4Ag+O2↑+4H+
B.FeS中加入足量稀硝酸:FeS+2H+=Fe2++H2↑
C.石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑
D.澄清石灰水中通入过量的CO2:CO2+OH﹣=HCO3﹣
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温常压下11.2 L乙烯气体含有的分子数为0.5NA
B.1 L 1 mol·L-1CH3 COONa溶液中含有NA个CH3 COO-
C.1 mol —OH(羟基)中含有10 NA个电子
D.16gCH3OH分子中含有的共价键数目为2.5NA个
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:填空题
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L?1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:

由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L?1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L?1 | 0.07 mol·L?1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
某同学利用右图所示装置制备乙酸乙酯。实验如下:
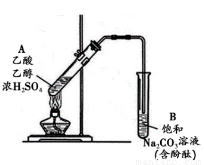
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A. ①中加热利于加快酯化反应速率,故温度越高越好
B. ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C. ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:推断题
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。
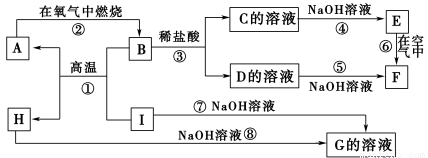
已知:H为两性氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含的同一种元素的是 。
⑵写出反应①的化学 方程式: 。
方程式: 。
⑶写出反应③的离子方程式: 。
⑷反应⑥过程中的现象是: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:实验题
某氯化亚铁和氯化铁的混合物.现要测定其中铁元素的质量分数,按如图步骤进行实验: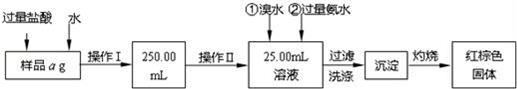
请根据以上流程,回答下列问题:
(1)样品溶解过程中加入少量浓盐酸的目的是什么?
操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有哪些仪器?
操作Ⅱ中可用的玻璃仪器是什么仪器?
(2)请写出加入氨水发生的离子反应方程式。
(3)沉淀洗涤的方法是什么?
(4)将沉淀物灼烧,冷却到室温,用天平称量其质量为b1g,再次灼烧并冷却至室温称量其质量为b2g,若b1﹣b2=0.3g,则接下来还应进行的操作是 .若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com