
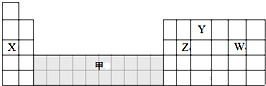
| A. | 可在灰色区域“甲”中寻找催化剂 | |
| B. | 离子半径:W->X+>Y3- | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | 工业上电解X和W化合物的水溶液制备X |
分析 题中表是元素周期表的一部分,由元素在周期表中的位置可知,X为Na、Y为N、Z为Si、W为Cl、甲处于过渡元素区域,
A.制造催化剂的元素一般位于周期表中过渡元素区;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
C.同周期随原子序数增大非金属性增强,非金属性越强,氢化物越稳定;
D.工业上电解熔融的NaCl生成Na.
解答 解:题中表是元素周期表的前5周期,由元素在周期表中的位置可知,X为Na、Y为N、Z为Si、W为Cl、甲处于过度元素区域,
A.甲处于过渡元素区域,制造催化剂的元素一般位于周期表中过渡元素区,故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:Cl->N3->Na+,故B错误;
C.同周期随原子序数增大非金属性增强,故非金属性Z<W,非金属性越强,氢化物越稳定,故氢化物稳定性Z<W,故C错误;
D.电解氯化钠溶液为氯碱工业原理,生成NaOH、氯气与氢气,而工业上电解熔融的NaCl生成Na,故D错误,
故选A.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置及元素周期律即可解答,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯、2-丁烯都存在顺反异构 | |
| B. | 乙二醇和丙三醇为同系物 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐降低 | |
| D. | 淀粉、纤维、脂肪、蛋白质都是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 放电时,Li+向负极移动 | |
| C. | 充电时,电极Li0.85NiO2质量会减小 | |
| D. | 放电时,负极的反应为:Li-e-═Li+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试液→(KSCN溶液)→颜色无变化→(+氯水)→溶液变成血红色,证明溶液中含有Fe2+ | |
| B. | 试液→(焰色反应)→产生黄色,证明溶液为氢氧化钠溶液 | |
| C. | 试液→(+石蕊)→溶液呈蓝色,证明试液一定是碱溶液 | |
| D. | 混合气体→(通过澄清石灰水)→变浑浊,证明混合气体中一定含有二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从NH4HCO3中闻到了刺激性气味 | B. | NaCl颗粒被粉碎 | ||
| C. | I2升华 | D. | NaOH溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②⑤ | C. | ②④⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
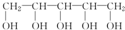 ,下列有关木糖醇的叙述中不正确的是( )
,下列有关木糖醇的叙述中不正确的是( )| A. | 木糖醇是一种单糖,与葡萄糖互为同系物 | |
| B. | 1 mol木糖醇与足量钠反应最多可产生2.5 mol H2 | |
| C. | 木糖醇易溶于水,能发生酯化反应 | |
| D. | 糖尿病患者可以食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L四氯化碳所含分子数为0.5 NA | |
| B. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3 NA | |
| C. | 25℃,压强为1.01×105 Pa时,11.2 L氦气所含的原子数目为 NA | |
| D. | 标准状况下,33.6 L H2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中加入过量氨水:Ag++3NH3.H2O═Ag(NH3)2OH+2H2O+NH4+ | |
| B. | 苯酚溶液中加入碳酸钠溶液:2C6H5OH+CO32-═2C6H5O-+CO2+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 碳酸钠溶液中缓缓加入少量的醋酸溶液:CO32-+CH3COOH═CH3COO-+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com