
| A. |  | B. |  | C. |  | D. |  |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度 | B. | 气体B、C的物质的量浓度之比 | ||
| C. | 气体B、D的质量之比 | D. | 气体C、D的物质的量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、Mg2+、SO42-、Na+ | D. | Na+、NH4+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+) | B. | H+个数 | C. | CH3COOH分子数 | D. | c(H+)/c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
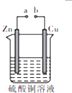
| A. | a和b不连接时,锌片上会有紫红色固体析出 | |
| B. | a和b用导线连接时,铜片上的电极反应是Cu2++2e-→Cu | |
| C. | a和b用导线连接时,溶液的颜色加深 | |
| D. | 无论a和b是否连接,锌片均会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的NH3和1mol的NH4+都有10×6.02×1023个质子 | |
| B. | 室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)<Kb(NH3•H2O) | |
| C. | NH4+(aq)+2O2(g)═NO3-(aq)+2H+(aq)+H2O(l);△H=-346kJ/mol | |
| D. | 在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com