
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与Na[Al(OH)4]溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A、②③⑤ | B、①②③ |
| C、③④⑤ | D、①③⑤ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )
莽草酸是一种合成药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物的说法正确的是( )| A、两种酸遇三氯化铁溶液都显色 |
| B、莽草酸分子和鞣酸分子中所含官能团相同 |
| C、等物质的量的两种酸与NaOH反应,消耗NaOH的量相同 |
| D、两种酸都能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纯碱是强碱弱酸盐 | 用纯碱溶液可清洗油污 |
| B | 不锈钢是合金 | 不锈钢在潮湿环境中容易被腐蚀 |
| C | Fe2O3是碱性氧化物 | Fe2O3可用作红色油漆和涂料 |
| D | NO2是红棕色气体 | 常温下可用铜与浓硝酸制取NO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| n(H2) |
| n(CO2) |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、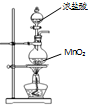 用装置制取氯气 |
B、 用装置除去氯气中的少量氯化氢和水蒸气 |
C、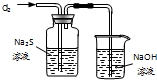 用装置可证明Cl2的氧化性强于S |
D、 用装置可以完成“喷泉”实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
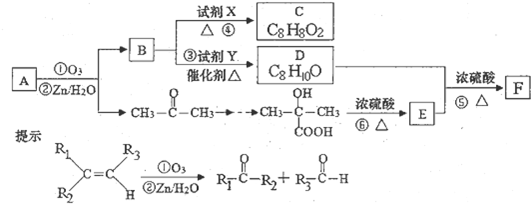
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )
将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积可能是( )| A、2.1mL | B、2.4mL |
| C、3.6mL | D、4mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |

| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com