
【题目】图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线正确的是( )
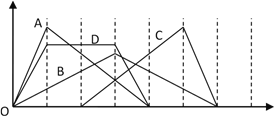
A. A曲线表示向AlCl3溶液中滴入NaOH溶液至过量
B. B曲线表示向NaAlO2溶液中通入CO2至过量
C. C曲线表示向n(HCl):n(AlC13)=1:1的混合溶液中滴入NaOH溶液至过量
D. D曲线表示向n[Ca(OH)2]:n(KOH)=1:2的混合溶液中通入CO2至沉淀消失
【答案】D
【解析】A.向AlCl3溶液中滴入NaOH溶液至过量,依次发生反应Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O 判断,消耗氢氧化钠是3:1,A项错误;B.向NaAlO2溶液中通入CO2至过量,NaAlO2和CO2反应产生白色沉淀氢氧化铝,沉淀不会溶解于二氧化碳中,B项错误;C.向n(HCl):n(AlC13)=1:1的混合溶液中滴入NaOH溶液至过量,依次发生反应OH-+H+=H2O、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;消耗氢氧化钠的量之比是1:3:1,C项错误;D.向n[Ca(OH)2]:n(KOH)=1:2的混合溶液中通入CO2依次发生反应CO2 + Ca2+ +2OH- =CaCO3 ↓+H2O,OH-+CO2═HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2设Ca(OH)2的物质的量为1mol,则KOH的物质的量为2mol,则各段反应消耗的二氧化碳的物质的量分别为1、2、1,D项正确;答案选D.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
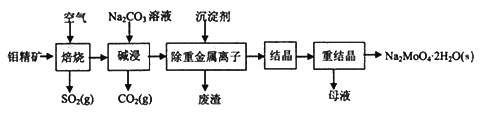
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学化学常见的物质,且甲、乙、丙均含有同一种元素。甲、乙、丙、丁之间的转化关系如右图所示,则乙不可能是( )
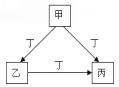
A. Al(OH)3 B. FeCl3 C. CO D. Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.3molCO2 , 在不同温度下反应CO2(g)+C(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( ) 
A.反应CO2(g)+C(s)2CO(g)△S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)>3P总(状态Ⅰ)
C.体系中c(CO2):c(CO2 , 状态Ⅱ)<3c(CO2 , 状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×10 12的溶液中:K+、Na +、CO32-、NO3-
=1×10 12的溶液中:K+、Na +、CO32-、NO3-
C. 浓度为3%的H2O2溶液:H+、Na+、C1-、SO32-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1mol Cl2参加化学反应,转移的电子数一定为2NA
B. 7.8g Na2O2 晶体中阴阳离子总数为0.4NA
C. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA
D. 标准状况下,由0.5mol NO和0.5mol O2组成的混合气体,分子数约为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 金属钠加入到CuSO4溶液中:2Na+Cu2+===Cu+2Na+
B. 将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO![]() +H2↑
+H2↑
C. 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO![]() +2Ba2++4OH- === 2BaSO4↓+AlO
+2Ba2++4OH- === 2BaSO4↓+AlO![]() +2H2O
+2H2O
D. 向Ba(AlO2)2溶液中通入少量CO2:2AlO![]() +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:某实验兴趣小组通过下图装置,利用稀硫酸、KClO3和草酸溶液制备ClO2,并用它来处理含Mn2+的工业废水。
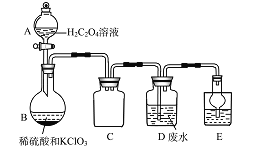
①A装置的名称是______________,C装置的作用为__________________。
②B中反应产物有ClO2、CO2等,请写出该反应的化学方程式:___________________。
③写出装置D中除去Mn2+的离子方程式__________________。(已知Mn2+转化为MnO2)
(2)ClO2易溶于水。用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样:量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol·L-1Na2SO3溶液滴定至终点,消耗Na2S2O3溶液V2mL。 (已知2Na2S2O3+I2=Na2S4O6+2NaI)
①滴定终点的判断依据是___________________。
②原ClO2溶液的浓度为_______________g/L(用步骤中的字母代数式表示)。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果___________(填“偏高”、“ 偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用碳在高温下还原二氧化硅制得粗硅,粗硅(合铁、铝、硼、磷等杂质)与氯气反应生成四氯化硅(反应温度450-500℃),四氧化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。(D的硬质玻璃管中盛装粗硅)

相关信息如下:a.四氧化硅遇水极易反应生成硅酸和氯化氢;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | — |
熔点/℃ | -70.0 | -107.2 | — | — | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出用碳在高温下还原二氧化硅制得粗硅的化学方程式_________________________。
(2)写出装置A中发生反应的离子方程式__________________________________。
(3)装置A中g管的作用是_________________;装置C中的试剂是____________;
(4)装置E中h瓶收集到的粗产物可通过多次蒸馏得到高纯度四氯化硅,蒸馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
(5)写出尾气处理装置中发生反应的离子方程式___________________________。
(6)本题实验装置中有一明显的不足之处,请简述你的改进方案及理由: ___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com