
 已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:
已知A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.A的原子半径最小,B的基态原子L层电子数是K层电子数的2倍,D的基态原子最外层电子排布式为nsnnpn+2,E为周期表中电负性最大的元素,F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,G与F同族且原子序数比F大2.回答下列问题:分析 A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.B的基态原子L层电子数是K层电子数的2倍,L层电子数为4,则B为碳元素;A的原子半径最小,则A为H元素;D的基态原子最外层电子排布式为nsnnpn+2,s能级容纳2个电子且P轨道容纳电子,则n=2,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E为周期表中电负性最大的元素,则E为氟元素;F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,则F为Fe;G与F同族且原子序数比F大2,则G为Ni.
解答 解:A、B、C、D、E、F、G为前四周期中常见元素,且原子序数依次增大.B的基态原子L层电子数是K层电子数的2倍,L层电子数为4,则B为碳元素;A的原子半径最小,则A为H元素;D的基态原子最外层电子排布式为nsnnpn+2,s能级容纳2个电子且P轨道容纳电子,则n=2,故D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E为周期表中电负性最大的元素,则E为氟元素;F元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,则F为Fe;G与F同族且原子序数比F大2,则G为Ni.
(1)F为Fe,原子的电子排布式为:1s22s22p63s23p63d64s2,其中含有7种能量不同的电子,
故答案为:1s22s22p63s23p63d64s2;7;
(2)NF3和NH3均是三角锥形分子,键角分别为102°和107.3°,为三角锥形结构,则N原子的杂化方式为sp3,其中NF3的键角比NH3的键角小的原因:NF3中成键电子对偏向F原子,NH3中成键电子对偏向N原子,成键电子对与成键电子对之间的斥力作用前者小于后者,
故答案为:sp3;NF3中成键电子对偏向F原子,NH3中成键电子对偏向N原子,成键电子对与成键电子对之间的斥力作用前者小于后者;
(3)C、N、O三种元素形成的一种粒子与二氧化碳分子互为等电子体,其化学式为CNO-,
故答案为:CNO-;
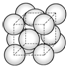
(4)G单质晶体中原子为面心立方最密堆积,以顶点原子为研究对象,与之相邻的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,则晶胞中G原子的配位数为$\frac{3×8}{2}$=12.若G原子半径为r cm,则晶胞边长为$\frac{\sqrt{2}}{2}$×4r cm=2$\sqrt{2}$r cm,则G原子所形成的最小正四面体空隙中,能填充的粒子的最大直径为( 2$\sqrt{2}$r cm-2r cm)=(2$\sqrt{2}$-2 )r cm,
故答案为:12;(2$\sqrt{2}$-2 )r.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、价层电子对互斥理论、等电子体、晶胞结构与计算等,是对物质结构主干知识的考查,需要学生具备一定空间想象与数学计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
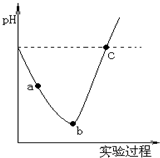 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
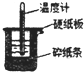 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品锈蚀时主要发生析氢腐蚀 | |
| B. | 施用适量石膏可以降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| C. | 电镀厂未经处理的废水可以直接用来灌溉农田 | |
| D. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
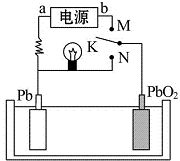
| A. | K与N相接时,Pb电极的反应式为Pb-2e-→Pb2+ | |
| B. | K与N相接时,SO42-向PbO2电极迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4 g乙烯与丙烯的混合气体含有NA个碳原子 | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64 g | |
| C. | 在1 L 0.1mol/L 的Na2CO3溶液中,阴离子总数小于0.1NA | |
| D. | 将1 L 2 mol/L 的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com