
| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
分析 A.根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色);
B.当二者恰好反应时,高锰酸钾消失,溶液变为无色;
C.酸性条件下碘离子易被氧化成碘单质,碘单质遇到淀粉显示蓝色;
D.难溶的氢氧化镁能够转化成更难溶氢氧化铁沉淀.
解答 解:A.甲基橙的变色范围是3.1-4.4,用酸滴定碱时,甲基橙加在碱里,达到滴定终点时,溶液颜色由黄变红,易于观察,故A正确;
B.向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,高锰酸钾溶液为紫红色,当二者恰好反应时溶液变为无色,所以一段时间后溶液突然变为无色,故B正确;
C.向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,由于碘离子被氧化成碘单质,则一段时间后溶液呈蓝色,故C错误;
D.向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现氢氧化镁白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,氢氧化镁沉淀变为红褐色的氢氧化铁沉淀,实现了沉淀的转化,故D正确;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及中和滴定、氧化还原反应、难溶物转化等知识,明确化学实验基本操作方法为解答关键,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证AgI的溶解度小于AgCl | 将NaI浓溶液加入AgCl悬浊液中,振荡,可观察到沉淀由白色变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Cl2中的HCl:将混合气体通过AgNO3溶液 | |
| B. | 除去C2H6中的C2H4:将混合气体通过酸性KMnO4溶液 | |
| C. | 检验CO2中是否混有HCl:将气体通入饱和NaHCO3溶液 | |
| D. | 检验Cl2中是否混有空气:将装有气体的试管倒置在NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质 结构 信息 | 单质银白色,燃烧时火焰呈黄色. | 其单质是空气的主要成分,化学性质非常稳定. | 原子的3p亚层上有5个电子. | +2价阳离子的核外电子排布与氖原子相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10与C3H6 | B. | C5H12与C2H6O | C. | C2H2Cl4与CH2Cl2 | D. | CH2O与C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
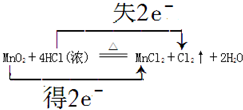
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com