
| A. | 等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应 | |
| B. | 0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝 | |
| C. | 0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性 | |
| D. | 0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g) |
分析 A.酸碱恰好反应,二元酸和二元碱按照物质的量1:1反应生成盐和水,和酸碱的强弱无关;
B.碱溶液中会电离出氢氧根离子显碱性,遇到红色石蕊试液变蓝;
C.0.010mol/LBCl2溶液呈酸性说明盐是强酸弱碱盐,0.010mol/LB2CO3溶液呈中性说明B2+离子水解显酸性,和碳酸根离子水解显示的碱性相当;
D.碱和铵盐反应可以生成氨气,强碱可以和铵盐反应生成氨气.
解答 解:A.酸碱恰好反应,二元酸和二元碱按照物质的量1:1反应生成盐和水,和酸碱的强弱无关,如Ba(OH)2和H2SO4的反应是强酸强碱反应,Cu(OH)2和H2SO4的反应是弱碱弱酸的反应,故A错误;
B.碱溶液中会电离出氢氧根离子显碱性,遇到红色石蕊试液变蓝,可以是强碱或弱碱,如NaOH强碱溶液、NH3•H2O弱碱溶液都可以使红色石蕊试液变蓝,故B错误;
C.0.010mol/LBCl2溶液呈酸性说明盐是强酸弱碱盐,说明对应B(OH)2是弱碱,0.010mol/LBCO3溶液呈中性说明B2+离子水解显酸性,和碳酸根离子水解显示的碱性相当说明对应B(OH)2是弱碱,故C正确;
D.碱和铵盐反应可以生成氨气,强碱可以和铵盐反应生成氨气,如NaOH和NH4Cl反应,不能说明B(OH)2是弱碱,故D错误;
故选C.
点评 本题考查了弱电解质的特征,注意证明是弱碱的判断依据需要说明存在电离平衡或形成的盐能水解等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
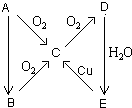 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
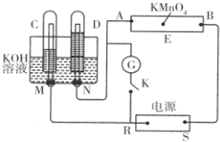 现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.
现有一套电化学装置,如图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞.A、B分别为Pt片,压在滤纸两端,R、S为电源的电极.M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
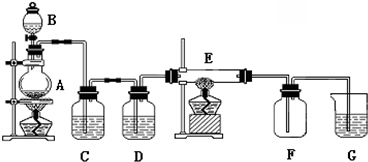
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com