
硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:

(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:(NH4)2Ce(NO3)6 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
在空气中加热(NH4)2Ce(NO3)6,除固体颜色有变化外,还可观察到的现象是_________。
(2)步骤Ⅰ中,将Ce(NO3)3·6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀。该过程中参加反应的氧化剂与还原剂物质的量之比为___________。
(3)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=___________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10—5mol·L-1,需调节pH为______以上。
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图。从图中可得出三条主要规律:
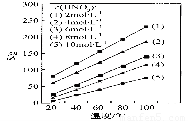
① (NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
② _____________________________________________;
③ _____________________________________________。
(1)NO? ;产生红棕色气体?????? (4分,每空2分)
(2)1:2?????? (3分)
(3)c(Ce4+)?[c(OH—)]4?? (3分) ;8??? (2分)
(4)②其它条件相同时,S随c(HNO3)减小而增大????? (2分)
③c(HNO3)越小,温度对S的影响越大或c(HNO3)越大,温度对S的影响越小? (2分)
【解析】
试题分析:(1)根据原子个数守恒、质量守恒可知,(NH4)2Ce(NO3)6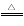 CeO2·8OH + 8NO↑;由于在此过程中有O2产生,常温下,NO与O2反应生成红棕色的NO2气体;(2)在配制过程中Ce由+3价升高到+4价,作还原剂,H2O2中O由—1价降低到—2价,作氧化剂,因H2O2中含有2个—1价的O,根据得失电子守恒,故氧化剂与还原剂物质的量之比为1:2;(3)沉淀Ce(OH)4存在的平衡为Ce(OH)4(s)
CeO2·8OH + 8NO↑;由于在此过程中有O2产生,常温下,NO与O2反应生成红棕色的NO2气体;(2)在配制过程中Ce由+3价升高到+4价,作还原剂,H2O2中O由—1价降低到—2价,作氧化剂,因H2O2中含有2个—1价的O,根据得失电子守恒,故氧化剂与还原剂物质的量之比为1:2;(3)沉淀Ce(OH)4存在的平衡为Ce(OH)4(s) Ce4+(aq)+4OH—(aq),故Ksp[Ce(OH)4]=c(Ce4+)?[c(OH—)]4;c(OH—)=
Ce4+(aq)+4OH—(aq),故Ksp[Ce(OH)4]=c(Ce4+)?[c(OH—)]4;c(OH—)= =
=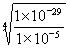 =1×10—6,298K时,Kw=1×10—14,c(H+)=1×10—8,即pH=8;(4)根据图像中曲线的走势可知,其它条件相同时,(NH4)2Ce(NO3)6随c(HNO3)减小而增大;根据图像中硝酸的浓度变化结合(NH4)2Ce(NO3)6的曲线,可知c(HNO3)越小,温度对(NH4)2Ce(NO3)6的溶解度的影响越大或c(HNO3)越大,温度对(NH4)2Ce(NO3)6的溶解度的影响越小。
=1×10—6,298K时,Kw=1×10—14,c(H+)=1×10—8,即pH=8;(4)根据图像中曲线的走势可知,其它条件相同时,(NH4)2Ce(NO3)6随c(HNO3)减小而增大;根据图像中硝酸的浓度变化结合(NH4)2Ce(NO3)6的曲线,可知c(HNO3)越小,温度对(NH4)2Ce(NO3)6的溶解度的影响越大或c(HNO3)越大,温度对(NH4)2Ce(NO3)6的溶解度的影响越小。
考点:考查质量守恒、氧化还原反应、沉淀溶解平衡、图像分析等。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com