
| ||
| ||
| ||
| 1mol |
| 4 |
| ||
| ||
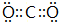 ,
,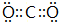 ;C+2H2SO4(浓)
;C+2H2SO4(浓)
| ||


科目:高中化学 来源: 题型:
| A、1 mol羟基(-OH)中含有的质子数为10 NA |
| B、相同状况下,22.4 L NO和11.2 L O2反应,生成物含有NA个分子 |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| D、1 mol Na2O2含有2 NA个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
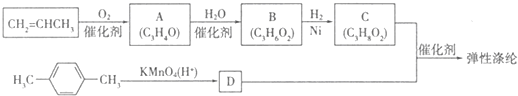
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处于最低能量的原子叫做基态原子 |
| B、4f 4表示4f能级有四个轨道 |
| C、同一原子中,2p、3d、4f能级的轨道数依次增多 |
| D、同一原子中,2p、3p、4p电子的能量逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
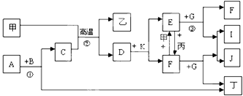 下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液.各物质间的转化如如图所示,回答下列各问题(部分生成物未列出):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L CH3COONa溶液和0.1mol/L HCl溶液等体积混合之后:c(Na+)=2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.2mol/L |
| B、0.1mol/LNa2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、25℃时,向10mL pH=4的盐酸中,加入pH=10的一元碱BOH溶液至pH刚好等于7,则反应后的溶液总体积:V总≤20mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com