
| A. | 电解质 | B. | 非电解质 | C. | 强酸 | D. | 氧化物 |
分析 A、在水溶液中或熔融状态下能导电的化合物为电解质;
B、在水溶液中和熔融状态下均不能导电的化合物为非电解质;
C、在水溶液中能完全电离、且电离出的阳离子全部是氢离子的化合物为强酸;
D、由两种元素构成、其中一种为氧元素的化合物为氧化物.
解答 解:A、在水溶液中或熔融状态下能导电的化合物为电解质,HClO在溶液中能电离出自由移动离子而导电,故为电解质,故A正确;
B、在水溶液中和熔融状态下均不能导电的化合物为非电解质,HClO在溶液中能电离出自由移动离子而导电,故为电解质,而不是非电解质,故B错误;
C、在水溶液中能完全电离、且电离出的阳离子全部是氢离子的化合物为强酸,而HClO在溶液中只能部分电离,故不是强酸,故C错误;
D、由两种元素构成、其中一种为氧元素的化合物为氧化物,而HClO中含三种元素,故不是氧化物,故D错误.
故选A.
点评 本题考查了电解质、非电解质、氧化物和酸的强弱的区分,难度不大,应注意概念的掌握.


科目:高中化学 来源: 题型:解答题
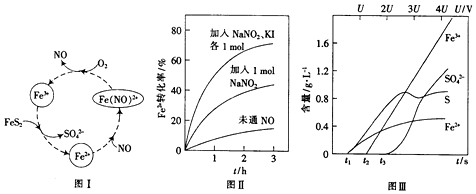
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | MgSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L水含有的分子数为0.1NA | |
| B. | 12g14C含有的中子数为8NA | |
| C. | 1 L0.1 mol•L-1 FeCl3溶液含阳离子数大于0.1NA | |
| D. | 1molN2和3 mol H2充分反应后,生成气体的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 催化剂可以改变该反应的热效应 | B. | 该反应是个放热反应 | ||
| C. | 反应物总能量低于生成物 | D. | 化学反应遵循质量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,旧键断裂放出能量,新键生成吸收能量 | |
| B. | 常温下,任何酸、碱间反应,每生成1mol水时的中和热都相同 | |
| C. | 放热反应在常温下都能自发进行 | |
| D. | 升高温度使活化分子百分数增大,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
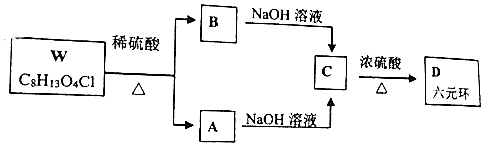
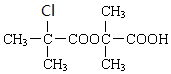 +H2O$→_{△}^{浓硫酸}$
+H2O$→_{△}^{浓硫酸}$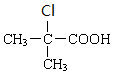 +
+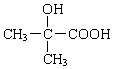 .
.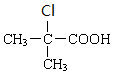 +2NaOH→
+2NaOH→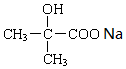 +2NaCl+H2O.
+2NaCl+H2O.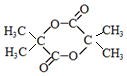 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解时有少量液体溅出 | B. | 洗涤液未全部转移到容量瓶中 | ||
| C. | 容量瓶使用前未干燥 | D. | 定容时液面未到刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com