
| A、碱金属元素与氧气反应均能形成过氧化物 |
| B、碱金属的密度随着原子序数的递增逐渐减小 |
| C、碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强 |
| D、碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
| A、431 kJ?mol-1 |
| B、946 kJ?mol-1 |
| C、649 kJ?mol-1 |
| D、896 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某微粒空间构型为平面三角形,则中心原子一定是sp2杂化 |
| B、某微粒空间构型为V形,则中心原子一定有孤电子对 |
| C、某微粒空间构型为三角锥形,则该微粒一定是极性分子 |
| D、某微粒空间构型为正四面体,则键角一定是109°28’ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸乙酯(HCOOC2H5) |
| B、硬脂酸甘油酯: |
| C、葡萄糖 (C6H12O6) |
| D、淀粉[(C6H10O5)n] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol/L |
| B、0.5 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HC
| ||
| C、pH=13的溶液中:K+、Na+、NO3-、ClO- | ||
| D、氯化铝溶液中Na+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
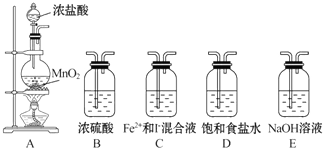
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中: 往A中滴加 往B中滴加 |
①A: ②B: 则假设1成立. ③A: ④B: 则假设2成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com