
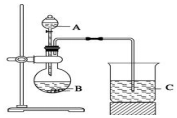
 一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验
一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验分析 运用弱酸制强酸或较强酸制较弱酸的实验原理,即用硫酸制取二氧化碳,用二氧化碳与硅酸钠反应制硅酸来一次性完成C、Si三种非金属元素的非金属性强弱比较,根据强酸制弱酸来回答即可;B的作用是发生装置是硫酸和碳酸钠溶液发生反应,C中二氧化碳和硅酸钠反应;由此分析解答.
解答 解:(1)较强酸制备较弱酸,因此可考虑把CO2气体通入Na2SiO3溶液,看是否有硅酸沉淀生成,比较特殊和硅酸的酸性强弱,B为溶液,则可判断B为Na2CO3,分液漏斗中是稀硫酸与B中碳酸钠反应制取CO2,判断硫酸和碳酸的酸性强弱,则A是稀硫酸,B是碳酸钠,C是硅酸钠溶液,
故答案为:稀硫酸;
(2)B仪器的名称是圆底烧瓶,故答案为:圆底烧瓶;
(3)烧杯C中应是硅酸钠和二氧化碳反应,硅酸钠易溶于水可写成离子,CO2是气体,要保留分子式,因此烧杯中反应的离子方程式是:SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足),或是SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量),
故答案为:SiO32-+CO2+H2O═H2SiO3↓+CO32-(CO2不足)或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-(CO2过量).
点评 本题将元素及其化合物、元素周期律与实验知识结合起来,考查了审题能力、思维能力,具有较强的综合性,题目难度中等.


科目:高中化学 来源: 题型:选择题
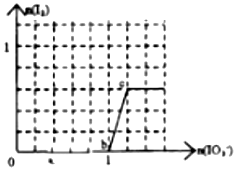 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X:位于元素周期表中的第三周期ⅢA 族 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氖原子相同 | |
| C. | 元素Z:它的原子中M层比L层少2个电子 | |
| D. | 元素W:它的化合物的焰色反应颜色呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
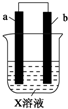 下列对如图所示装置实验现象的描述错误的是( )
下列对如图所示装置实验现象的描述错误的是( ) | a电极 | b电极 | X溶液 | |
| ① | Cu | Zn | CuCl2 |
| ② | Zn | 石墨 | HCl |
| A. | 实验①中a极质量增加 | B. | 实验①中Cl-离子向正极移动 | ||
| C. | 实验②a极质量减少 | D. | 实验②中b极放出无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊不消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊;再加入品红溶液,溶液为红色 | Ca(ClO)2溶液 |
| D | 通入SO2,溶液没有明显变化;再通入氨气,溶液变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com