
(9分)将4molSO2和2molO2的混合气体置于体积可变的恒压容器中,在一定条件下发生如下反应2SO2(g)
+ O2(g)  2SO3(g)
ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
2SO3(g)
ΔH<0,该反应达平衡时,测得气体总物质的量为4.2mol,试回答:
(1)在该平衡时,n(SO3)= mol
(2)若起始时加入1.2molSO2 、0.6molO2 和xmolSO3 ,达到平衡时各气体体积分数与上述平衡状态相同,则x的取值范围是
(3)若反应开始时v(逆)> v(正),达到上述平衡状态时,气体的总物质的量仍为4.2mol,则起始时n(SO3)的取值范围是
(4)若反应过程中SO2、O2、SO3物质的量变化如图所示。则反应进行至20min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
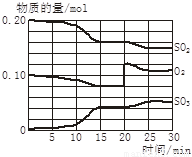
A. 加了催化剂 B. 缩小容器体积
C. 降低温度 D. 增加SO3的物质的量
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为_____________________________________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g) ![]() qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)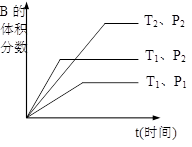
(3)在FeCl3+3KSCNFe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体,平衡 _____________移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com