
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
分析 该题2SO2(g)+O2(g)?2SO3(g)是一个可逆反应.假设SO2(g)和O2(g)全部转化为SO3(g).
2SO2(g)+O2(g)?2SO3(g)
初始 0.4mol?L-1 0.2mol?L-1 0.4mol?L-1
变化 0.4mol?L-1 0.2mol?L-1 0.4mol?L-1
平衡 0 0 0.8mol?L-1
假设SO3(g)全部转化为SO2(g)和O2(g)
2SO2(g)+O2(g)?2SO3(g)
初始 0.4mol?L-1 0.2mol?L-1 0.4mol?L-1
变化 0.4mol?L-1 0.2mol?L-1 0.4mol?L-1
平衡 0.8mol?L-1 0.4mol?L-1 0
该反应是一个可逆反应,无论向正反应方向进行还是向逆反应方向进行,实际不可能100%转化,以此解答该题.
解答 解:由以上分析可知达到平衡时:0<n(SO2)<0.8mol?L-1 ;0<n(O2)<0.4mol?L-1 ;0<n(SO3)<0.8mol?L-1 ,
A.SO2为0.8mol/L,O2为0.4 mol/L不在范围内,不符合条件,故A不选;
B.如平衡逆向移动,SO2为0.5 mol/L<0.8mol?L-1 ,在范围内,符合条件,故B选;
C.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度为0.8mol/L,实际应小于该值,故C不选;
D.反应物、生产物的浓度不可能同时减小,一个浓度增大,另一个浓度一定减小,故D不选.
故选B.
点评 本题考查了化学平衡的建立,题目难度中等,解题关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法,本题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
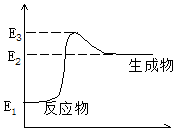 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )| A. | 减小压强时,Q的值增大 | B. | 升高温度时,Q的值减小 | ||
| C. | 该反应是吸热反应 | D. | Q=E3-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个-CH3,能生成3种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成2种一氯代物 | D. | 4个-CH3,能生成2种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com