
| A.明矾净化水 |
| B.用氢氧化铝治疗胃酸过多 |
| C.用铝制容器存放浓硫酸 |
| D.电解熔融氧化铝制单质铝 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题


| A.b曲线表示的是向X溶液中加入NaOH溶液 |
| B.在O点时两方案中所得溶液浓度相等 |
| C.a、b曲线表示的反应都是非氧化还原反应 |
| D.X溶液显酸性,Y溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
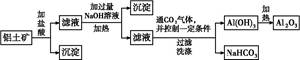
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
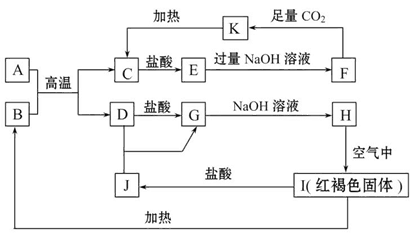
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
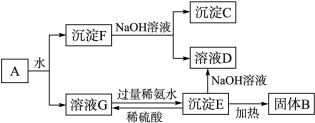
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合金中镁的质量分数为63.3%≤Mg%<100% |
| B.该合金中含有铝的质量至少为5.4 g |
| C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 |
| D.在产生沉淀后的溶液中有1.5 mol Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com