
分析 (1)依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸体积;
(2)配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,依据操作步骤选择需要的仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)设需要浓硫酸体积V,则依据溶液稀释过程中所含溶质的物质的量不变得:18mol/L×V=100mL×2.8mol•L-1,解得V=15.6mL;
故答案为:15.6;
(2)配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器:烧杯、量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,还需的定量仪器为:100mL容量瓶;
故答案为:100mL容量瓶;
(3)①用量筒量取浓硫酸时俯视刻度线,导致量取的浓硫酸体积偏小,硫酸的物质的量偏小,溶液浓度偏低,故答案为:偏低;
②定容时俯视刻度线偏高,导致溶液体积偏大,溶液浓度浓度偏高,
故答案为:偏高;
点评 本题考查一定物质的量浓度溶液的配制及误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.


科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化碳具有漂白性 |
| B | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1FeCl3溶液,再加入3滴1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>ksp[Fe(OH)3] |
| C | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色的快慢 | 证明随着溶液pH的减小,“84”消毒液的氧化能力增强 |
| D | 相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
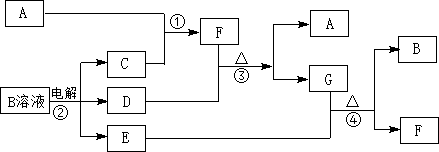 (1)写出化学式FNH3,
(1)写出化学式FNH3,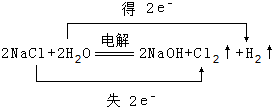 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
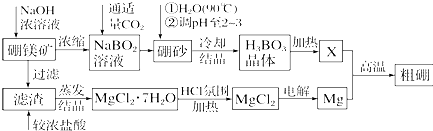
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
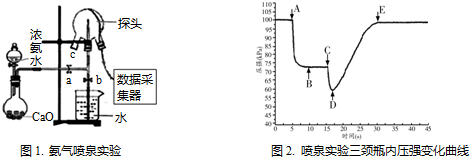
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com