

���� ��1���ٻ�ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ�
��Ҫʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$ ��������ݷ�Ӧ��ƽ��������Ӧ�����ƶ����ɣ�
�۸���ͼ�����ݽ��ƽ�ⳣ��K�ļ��㹫ʽ���м��㣬����K�����¶��йؼ���ӦΪ�������жϸı�������
��2�������ȸ��������ӵ��ƶ�������ȷ����������Ȼ�����ԭ���ԭ����д�缫��Ӧʽ��
��������·��ת�Ƶ��ӵ���Ŀ��ȣ����Ը��ݵ���ת�Ƶ���Ŀ��ͬ���г���֪���ʺ�δ֪����֮���ϵʽ��Ȼ��ͨ����ϵ����⣻
��� �⣺��1����A��CO2����������ڻ�������б��ֲ��䣬����˵���ﵽƽ��״̬����A��ȷ��
B���ܶ�=$\frac{������}{���}$��������һ�������һ�������ܶ�һ�����ʻ����������ʲ��ٷ����ı䲻��˵���ﵽƽ��״̬����B����
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4molH2O�������������淴Ӧ���ʲ���˵���ﵽƽ��״̬����C����
D��H2O��CH3OH���Dz�����Ұ���1��1�ı������ɣ�����H2O��CH3OH�����ʵ���Ũ��֮��һֱΪ1��1������˵���ﵽƽ��״̬����D����
��ѡA��
��Ҫʹ$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$��������ݷ�Ӧ��
A�������¶ȣ�ƽ�������ƶ�������$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$��С����A����
B�����º����³���He��g����ƽ�ⲻ�ƶ�������$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$���䣬��B����
C����H2O��g������ϵ�з��룬ƽ�������ƶ�������$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����C��ȷ��
D�����º����ٳ���2mol CO2��3mol H2����Ч�ڿ�ʼ����4molCO2��6molH2��ѹǿ����ƽ�������ƶ�������$\frac{n��C{H}_{3}OH��}{n��C{O}_{2}��}$����D��ȷ��
��ѡ��CD��
����ͼ������CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼŨ�ȣ�1 1.5 0 0
ת��Ũ�ȣ�0.25 0.75 0.25 0.25
ƽ��Ũ�ȣ�0.75 0.75 0.25 0.25
����K=$\frac{0.25��0.25}{0.75��0.7{5}^{3}}$=0.20����ҪʹK=1���ַ�Ӧ�������Խ����¶�ʹƽ��������Ӧ�����ƶ����ʴ�Ϊ��0.20��C��
��2����M��������������һ����Ӧ��ԭ��صĸ���������������Ӧ���缫��ӦʽΪ��CH3OH-6e-+H2O=CO2+6H+��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2+6H+��
���ö��Ե缫����ⱥ��ʳ��ˮ�ܵĵ缫��ӦʽΪ2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH-��
pHֵ��Ϊ13ʱ��pOH=1��c��OH-��=0.1mol/L��n��OH-��=0.1mol/L��0.3L=0.03mol���ɷ���ʽCH3OH-6e-+H2O=CO2+6H+��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH-��֪
CH3OH��6e-��6OH-
32g 6mol
m��CH3OH�� 0.03mol
��m��CH3OH��=32g��0.03mol��6mol=0.16g��
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$H2��+Cl2��+2OH-��0.16g��
���� ���⿼���˻�ѧƽ����й�֪ʶ���缫��Ӧʽ����д�ȣ��ۺ���ǿ�����ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
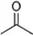 �����ݼ���ʽ�ش��������⣺
�����ݼ���ʽ�ش��������⣺ ����ʽ��C5H9O2���ṹ��ʽ��CH2=CH��CH3��COOCH3��
����ʽ��C5H9O2���ṹ��ʽ��CH2=CH��CH3��COOCH3�� ��
��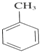 +3HNO3$��_{��}^{Ũ����}$
+3HNO3$��_{��}^{Ũ����}$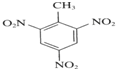 +3H2O��
+3H2O�� ��һ��ȡ������2�֣�
��һ��ȡ������2�֣�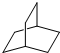 �Ķ���ȡ������7�֣�
�Ķ���ȡ������7�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��I�� | �ڢ��� | �ڢ��� |
| A | ������NaOH��Һ��Ͷ����Ƭ | ������NaOH��Һ��Ͷ����Ƭ | Al+2OH-+2H2O�T2AlO2-+3H2�� |
| B | ��Fe2��SO4��3��Һ�е�������������Һ | ��Fe2��SO4��3��Һ�е�������������Һ | Fe3++3OH-�TFe��OH��3�� |
| C | NaHCO3��Һ����Ca��OH��2��Һ | NaHCO3��Һ����NaOH��Һ | OH-+HCO3-�TCO32-+H2O |
| D | ��NaOH��Һ��ͨ�����CO2���� | ��NaOH��Һ��ͨ������CO2���� | CO2+OH-�THCO3- |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼����ļ������ | B�� | ����Ķ��ȴ���Ľṹֻһ�� | ||
| C�� | �ĸ�̼����ļ������ | D�� | �����һ�ȴ���ֻ��һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | ���������� | ���� |
| A | ��0.1 mol•L-1��ˮϡ�ͳ�0.01 mol•L-1����� pH��11.1��� 10.6 | ϡ�ͺ�NH3•H2O�ĵ���̶ȼ�С |
| B | �����£���ñ���Na2CO3��Һ��pH���� ����NaHCO3��Һ | ������ˮ��̶ȣ� CO32-��HCO3- |
| C | ��25 mL��ˮ�ͷ�ˮ�зֱ����5��FeCl3������Һ��ǰ��Ϊ��ɫ������Ϊ���ɫ | �¶����ߣ�Fe3+��ˮ��̶����� |
| D | ��������NaOH�Ҵ���Һ���Ȳ��������� ͨ��KMnO4������Һ�У���Һ��ɫ | ����������Ϊ��ϩ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
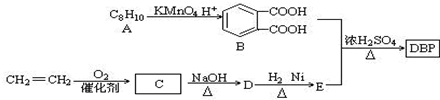
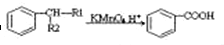
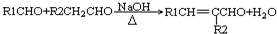 ��-R1��-R2��ʾ��ԭ�ӻ�������
��-R1��-R2��ʾ��ԭ�ӻ�������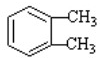 ��D�Ľṹ��ʽ��CH3CH=CHCHO��D��E�ķ�Ӧ���ͼӳɣ���ԭ����Ӧ��
��D�Ľṹ��ʽ��CH3CH=CHCHO��D��E�ķ�Ӧ���ͼӳɣ���ԭ����Ӧ��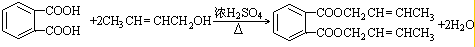 ��
��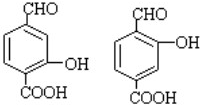 ��
��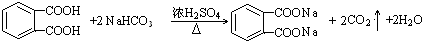 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
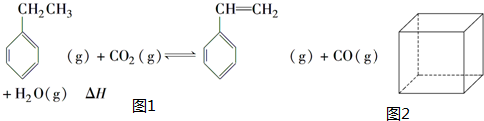
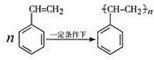 �������飨C8H8���ļ���ʽ�ṹ��ͼ2��ʾ�����ͱ���ϩ�Ĺ�ϵ��ͬ���칹�壨�ͬλ�ء�����ͬ�������塱����ͬ���칹�塱��ͬϵ�����
�������飨C8H8���ļ���ʽ�ṹ��ͼ2��ʾ�����ͱ���ϩ�Ĺ�ϵ��ͬ���칹�壨�ͬλ�ء�����ͬ�������塱����ͬ���칹�塱��ͬϵ�����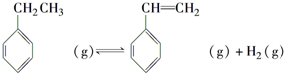 ��H1=+117.6kJ•mol-1
��H1=+117.6kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
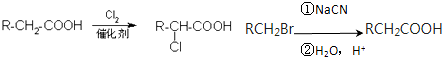
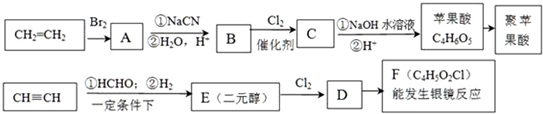
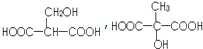 ��
��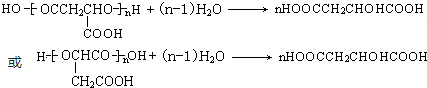 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com