
分析 (1)Mg与氯水中的HCl反应生成氯化镁和氢气;
(2)氯气与氯化亚铁反应生成氯化铁;
(3)Na2CO3与盐酸反应生成氯化钠和二氧化碳、水;
(4)氯离子与银离子反应生成AgCl沉淀.
解答 解:(1)向新制氯水中加入金属Mg,Mg与氯水中的HCl反应生成氯化镁和氢气,其反应的方程式为:Mg+2HCl=MgCl2+H2↑;
故答案为:Mg+2HCl=MgCl2+H2↑;
(2)氯水中加入FeCl2溶液,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)向新制氯水中加入Na2CO3,Na2CO3与盐酸反应生成氯化钠和二氧化碳、水,其离子方程式为:CO32-+2H+=CO2↑+H2O;
故答案为:CO32-+2H+=CO2↑+H2O;
(4)氯水中加入AgNO3溶液,氯离子与银离子反应生成AgCl沉淀,发生反应的离子方程式为Cl-+Ag+=AgCl↓,
故答案为:Cl-+Ag+=AgCl↓.
点评 本题考查了氯水的成分及其性质,把握氯气、HCl、HClO的性质为解答的关键,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

| A. | B F | B. | A E | C. | B E | D. | A D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b时:c(OH-)=c(H+)+c(HS-) | |
| B. | a=2b时:C(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| C. | a=2.5b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) | |
| D. | 若4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S),a=3b |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 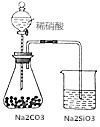 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硝酸 | CaCO3 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,同时产生白烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com