
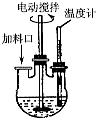
 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.分析 (1)增大反应物浓度、反应物接触面积及升高温度、加入催化剂都能加快反应速率;
(2)温度高时碘易升华;
(3)水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2;
(4)通过搅拌器搅拌,反应物混合更均匀,且利用气体排出;
(5)碘的溶解性较小,则反应的后期I2与Na2CO3溶液反应难以进行,但碘易和水合肼反应,所以此阶段需对投料顺序作适当改进;
(6)①将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2 CO3溶液、过滤,氢氧化钡除去硫酸根离子、碳酸钠除去钡离子,NaI的溶解性和NaCl相似,温度越高其溶解度越大,为防止NaI结晶析出,应该趁热过滤;
②溶液在不断搅拌下加入HI至溶液的PH约为6,HI用于除去过量的碳酸钠,然后冷却结晶,再次过滤,洗涤晶体2~3次,在真空干燥箱中干燥.
解答 解:(1)增大反应物浓度、反应物接触面积及升高温度都能加快反应速率,
a.将碘块研成粉末,增大反应物接触面积,加快反应速率,故a选;
b.根据方程式①②知,NaI相当于催化剂,能加快反应速率,故b选;
c.将溶液适当加热,增大活化分子百分数,反应速率加快,故c选;
d.加大高纯水的用量,降低单位体积内活化分子个数,降低反应速率,故d不选;
故选abc;
(2)温度越高反应速率越快,但温度高时碘易升华,所以温度不宜超过70℃,
故答案为:防止碘升华;
(3)水合肼(N2H4•H2O)具有强还原性,可分别将IO-、IO3-和I2还原为I-,本身被氧化为N2,
其中一个反应方程式为2IO-+N2H4.H2O=2I-+N2↑+3H2O或2IO3-+3N2N4.H2O=2I-+3N2↑+9H2O,
故答案为:2IO-+N2H4.H2O=2I-+N2↑+3H2O或2IO3-+3N2N4.H2O=2I-+3N2↑+9H2O;
(4)通过搅拌器搅拌,反应物混合更均匀,且利用气体排出,
所以整个实验过程中都需要开动搅拌器,故答案为:使合成反应均匀进行,并使产生的二氧化碳、氮气等气体及时排出;
(5)碘的溶解性较小,则反应的后期I2与Na2CO3溶液反应难以进行,但碘易和水合肼反应,所以此阶段需对投料顺序作适当改进,调整顺序为:先加入碘、水合肼,最后加入碳酸钠,
故答案为:先加入碘、水合肼,最后加入碳酸钠;
(6)①将溶液在不断搅拌下依次加入稍过量的Ba(OH)2溶液、稍过量的Na2 CO3溶液、过滤,氢氧化钡除去硫酸根离子、碳酸钠除去钡离子,NaI的溶解性和NaCl相似,温度越高其溶解度越大,为防止NaI结晶析出而导致NaI产率降低,所以应该趁热过滤,
故答案为:趁热过滤;除去活性炭,并防止温度降低NaI结晶析出降低产率;
②溶液在不断搅拌下加入HI至溶液的PH约为6,HI用于除去过量的碳酸钠且不引进新的杂质,然后冷却结晶,再次用高纯水过滤,洗涤晶体2~3次,在真空干燥箱中干燥,从而得到纯净、干燥的NaI,
故答案为:HI溶液;冷却结晶;高纯水.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、获取题给信息并分析解答问题能力,明确实验操作规范性、元素化合物性质、化学反应原理是解本题关键,注意题给信息的正确、灵活运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:AlO2-、K+、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
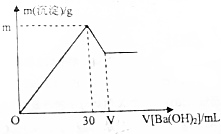 现有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)
现有10mL1mol/LAl2(SO4)3溶液,向其中逐滴滴加一定物质的量浓度的Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.(已知:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com