
【题目】有机化合物D是重要的有机化工中间体,以丙烯为原料合成D的流程如下:

已知:
①在一定条件下,烯烃中α—H能与C12发生取代反应,生成氯代烯烃,但双键碳上的氢原子很难发生取代反应。
②
回答下列问题:
(1)B的结构简式为___________,B→C的反应类型是___________。
(2)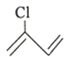 的名称为___________,该有机物分子中最多有___________个原子共平面。
的名称为___________,该有机物分子中最多有___________个原子共平面。
(3)反应C→D的化学方程式为______________________________________________。
(4)写出用1,3-丁二烯为原料制备化合物 的合成路线_________(其他试剂任选。提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)。合成路线流程图示例:CH3CH2OH
的合成路线_________(其他试剂任选。提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)。合成路线流程图示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH3CH2Cl。
CH3CH2Cl。
【答案】 CH2=CH-CH2Cl 取代或水解反应 2-氯-1,3-丁二烯 10 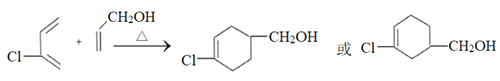 CH2=CH-CH=CH2
CH2=CH-CH=CH2![]() CH2Cl-CH=CH-CH2Cl
CH2Cl-CH=CH-CH2Cl![]() CH2OH-CH=CH-CH2OH
CH2OH-CH=CH-CH2OH![]() CH2OH-CHCl-CH2-CH2OH
CH2OH-CHCl-CH2-CH2OH![]()
![]()
【解析】分析:根据已知信息①可知丙烯在高温下和氯气发生甲基上氢原子的取代反应生成B,B的结构简式为CH2=CHCH2Cl,B发生水解反应生成C,则C的结构简式为CH2=CHCH2OH。B与![]() 发生已知信息②的反应生成D,则D的结构简式为
发生已知信息②的反应生成D,则D的结构简式为 ,据此解答。
,据此解答。
详解:(1)根据以上分析可知B的结构简式为CH2=CH-CH2Cl,B→C的反应类型是取代或水解反应。
(2)![]() 含有2个碳碳双键,名称为2-氯-1,3-丁二烯。由于碳碳双键是平面形结构,分子中所有原子均可能共面,则该有机物分子中最多有10个原子共平面。
含有2个碳碳双键,名称为2-氯-1,3-丁二烯。由于碳碳双键是平面形结构,分子中所有原子均可能共面,则该有机物分子中最多有10个原子共平面。
(3)根据已知信息②可知反应C→D的化学方程式为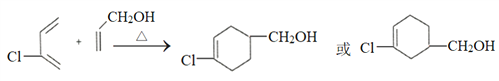 。
。
(4)利用逆推法可知用1,3-丁二烯为原料制备化合物![]() 的合成路线图为CH2=CH-CH=CH2
的合成路线图为CH2=CH-CH=CH2![]() CH2Cl-CH=CH-CH2Cl
CH2Cl-CH=CH-CH2Cl![]() CH2OH-CH=CH-CH2OH
CH2OH-CH=CH-CH2OH![]() CH2OH-CHCl-CH2-CH2OH
CH2OH-CHCl-CH2-CH2OH![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期主族元素,且原子序数依次增大。在短周期中A元素原子半径最小,D元素原子半径最大,B的简单氢化物的水溶液呈碱性,C、E同主族,形成的化合物为EC2、EC3。回答下列问题:
(1)E在元素周期表中的位置为__________。
(2)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与Na2O2的结构和化学性质相似,其溶液显黄色。H的电子式为______。
(3)化学家发现一种化学式为A4B4的化合物,由均带一个电荷的阴、阳离子组成,则该阴、阳离子为_______。
(4)B2A4C3是一种常见的炸药,其在常温下撞击时会生成一种气体(B2C)和一种常见液体,该反应的化学力程式为______________。8g该物质反应转移的电子数目为________。
(5)下列事实能说明元素F的非金属性比元素E的非金属性强的是______。
a.元素F形成的单质比元素E形成的单质的熔点低
b.F和E两元素的简单氢化物受热分解,前者的分解温度高
c.F2通入到D2E的溶液中出现浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
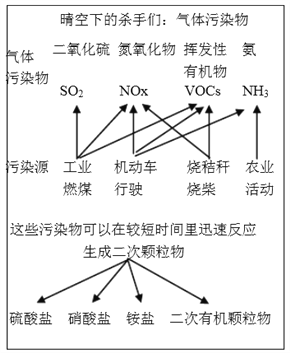
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。
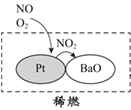
(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:
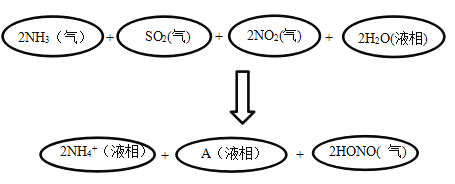
请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.元素周期表中有7个主族、7个副族
B.稀有气体元素原子的最外层电子数均为8
C.氢是原子半径最小的元素
D.硫元素位于第3周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
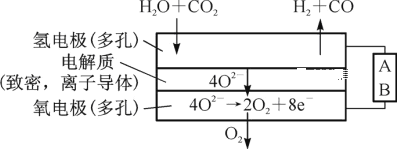
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 碳酸氢根离子发生电离:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 用铂电极电解MgCl2溶液:2H2O+2Cl-![]() H2↑+2OH-+Cl2↑
H2↑+2OH-+Cl2↑
C. 将氯气通入NaOH溶液中:Cl2+2OH-==Cl-+ClO-+H2O
D. 将蛋壳浸泡到醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐是______(填他学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4_____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为______。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸人一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。则K2FeO4酸化时发生反应的离子方程式为_________;K2FeO4作为净水剂的优点除铁无毒外还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。
(1)以下操作顺序不合理的是 _______。
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)通过步骤①中过滤后的滤液,检验SO42-是否除尽的操作方法是_________________________
Ⅱ.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)图1中通入CO2后所得溶液的溶质成分为____________________;
(2)图3中通入CO2后所得溶液的溶质成分为____________________。
Ⅲ.已知氮化镁极易与水反应:Mg3N2+6H2O===2NH3↑+3Mg(OH)2↓。将足量的镁条置于空气燃烧,可能会发生下列反应①2Mg+O2![]() 2MgO;②3Mg+N2
2MgO;②3Mg+N2![]() Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2![]() 2MgO+C;④Mg+H2O(g)
2MgO+C;④Mg+H2O(g)![]() MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
MgO+H2。请设计一个实验,验证产物中含有氮化镁(Mg3N2):_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com