
 ,
, ;
;

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,KOH是还原剂 |
| B、被还原的氯元素的质量是被氧化的氯元素质量的5倍 |
| C、若反应中消耗12mol KOH,则转移10mol电子 |
| D、将KClO3和KCl的混合物加入到硫酸中反应,不可能产生Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
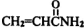 )具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.
)具有中等毒性.A-K几种有机物间的转化关系如图所示(部分条件和产物略去).已知:A为气态烃,标准状况下密度为2.5g/L,且核磁共振氢谱有4个吸收峰;G比丙烯酰胺多一个CH2原子团.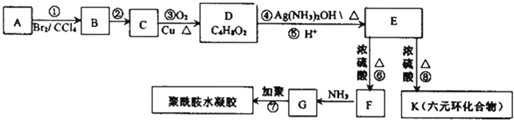
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )| A、如图条件下实验过程中没有热量损失 |
| B、若改用60mL 0.50mol/L盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等 |
| C、图中实验装置缺少环形玻璃搅拌棒 |
| D、烧杯间填满碎纸条的作用是固定小烧杯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com