
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 1.01×105Pa,120℃时水为气体,设烃的化学式为CxHy,写出燃烧的化学方程式:CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O,根据燃烧前后体积不变找出烃的分子式的组成特点,进而进行判断.
解答 解:设烃的化学式为CxHy,则燃烧的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O,
完全燃烧后恢复到原来的温度和压强,体积不变,1.01×105Pa,120℃时水为气态,
则:1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,
解得:y=4,
常见含有4个H原子的烃有:CH4、C2H4、C3H4,
则烃分子式中所含的碳原子数不可能为4,
故选D.
点评 本题考查有机物分子式的确定,题目难度不大,注意从燃烧前后的体积变化找出分子的组成特点,注意常见有机物的分子组成,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.
,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.
(1)CH3+、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是CDE.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
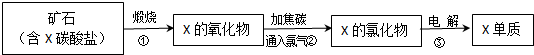
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在顺反异构 | B. | 经加聚反应得树脂 | ||
| C. | 属于盐类 | D. | 使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com