
| A. | 金刚石>晶体硅>碳化硅 | B. | K>Na | ||
| C. | HCHO<CH3OH | D. | NaF<NaCl<NaBr |
分析 A.原子晶体中半径越小,共价键越强,熔点越高;
B.金属晶体中原子半径越小,电荷越大,熔点越高;
C.分子晶体中相对分子质量越大,熔点越高,分子间含有氢键时熔点较高;
D.离子晶体中离子半径越小,电荷越大,熔点越高.
解答 解:A.因键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,故A错误;
B.因K、Na的电荷相同,钠原子半径<钾原子半径,则熔点为Na>K,故B错误;
C.分子晶体中相对分子质量越大,熔点越高,分子间含有氢键时熔点较高,CH3OH分子间存在氢键,则熔点为HCHO<CH3OH,故C正确;
D.因离子半径F-<Cl-<Br-,则熔点为NaF>NaCl>NaBr,故D错误;
故选C.
点评 题考查晶体熔点的比较,明确不同类型晶体熔点的比较方法是解答本题的关键,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 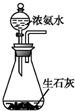 可制取氨气 | |
| B. | 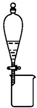 可分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. | 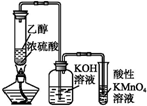 可制取乙烯并验证其易被氧化 | |
| D. | 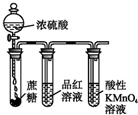 可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
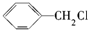
 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下: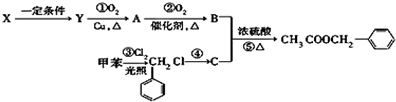
 发生反应④所需的条件是氢氧化钠水溶液、加热,该反应的反应类型为水解反应.
发生反应④所需的条件是氢氧化钠水溶液、加热,该反应的反应类型为水解反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
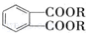 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: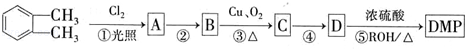
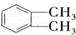 的名称1,2-二甲苯(或邻二甲苯),D中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),D中官能团的名称为醛基,DMP的分子式为C10H10O4.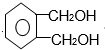 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$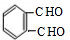 +2H2O.
+2H2O.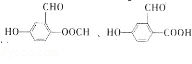 .
. 制备DMP的另一种途径:
制备DMP的另一种途径: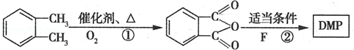
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合物中CuO和Fe2O3的物质的量的比为1:1 | |
| B. | 参加反应的CO的质量为11.2g | |
| C. | 原混合物中Fe元素的质量为5.6g | |
| D. | 原混合物中CuO的质量分数约为33.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com