
 甲醇、乙醇、氨气等都是重要的化工原料.
甲醇、乙醇、氨气等都是重要的化工原料.分析 (1)①K=$\frac{生成物平衡浓度幂之积}{反应物平衡浓度幂之积}$;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③用化学反应速率和化学平衡综合分析又快又多地生产甲醇;
(2)当体积扩大2倍,若平衡不移动,各物质的浓度是原来的2倍,但实际上减压平衡向气体体积增大的方向移动;
(3)如加入N2和H2物质的量之比为1:3,二者的转化率相等,此时加入2molN2和4molH2,n(N2):n(H2)>1:3,加入N2的量相对较多,则达到平衡时,H2的转化率将高于N2;恒温恒容条件下,对于气体体积可变的反应,投料要与原平衡折算等量才能建立等效平衡.
解答 解:(1)①K=$\frac{生成物平衡浓度幂之积}{反应物平衡浓度幂之积}$=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,
故答案为:K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$;
②A.2v正(CO)=v逆(H2),不同物质表达速率时,方向相反,且与计量数成比例,说明正逆反应速率相等,达到平衡,故A正确;
B.达平衡时是各物质的浓度保持不变,c(CO):c(H2)=1:2不一定达到平衡,故B错误;
C.气体的总质量不变,容器的体积不变,气体密度始终不变,则密度不变时不一定达到平衡,故C错误;
D.这是一个气体体积缩小的反应,在恒压容器中,当气体体积不变,则各物质的量保持不变,达到平衡状态,故D正确;
故答案为:AD;
③A.增加CO的浓度,平衡正向移动,且反应速率、H2平衡转化率、平衡时甲醇的体积分数均增大,故A正确;
B.增加H2的浓度,CO的转化率增大,H2平衡转化率反而降低,故B错误;
C.降低温度,反应速率减慢,故C错误;
D.增大压强,平衡正向移动,且反应速率、H2平衡转化率、平衡时甲醇的体积分数均增大,故D正确;
故答案为:AD;
(2)当体积扩大2倍,若平衡不移动,各物质的浓度是原来的$\frac{1}{2}$,但实际上减压平衡向气体体积增大的方向移动,即逆方向移动,NH3的体积分数减小,N2的浓度在减小的基础上略有增加,
故答案为:<;>;
(3)如加入N2和H2物质的量之比为1:3,平衡时二者的转化率相等,此时加入2molN2和4molH2,n(N2):n(H2)>1:3,加入N2的量相对较多,则达到平衡时,H2的转化率将高于N2;恒温恒容条件下,对于气体体积可变的反应,投料要与原平衡折算等量才能建立等效平衡,
N2(g)+3H2(g)?2NH3(g)
原始投料:2mol 4mol 0mol
现在投料:1mol amol bmol
向右折算:$\frac{b}{2}$mol $\frac{3b}{2}$mol 0mol
则1mol+$\frac{b}{2}$mol=2mol,amol+$\frac{3b}{2}$mol=4mol,解得a=1mol,b=2mol,
故答案为:<;1;2.
点评 本题考查了化学平衡常数表达式的书写,化学平衡状态的判断,化学平衡的移动,难度不大,注意恒温恒容条件下等效平衡的建立.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
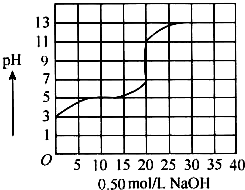 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
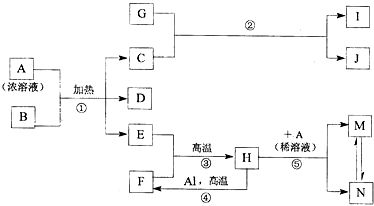
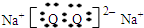 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
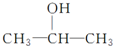 的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )
的四种有机物的1H核磁共振谱(1H-NMR).其中属于CH3CH2CH2OH的1H-NMR谱图的是( )| A. |  | B. | 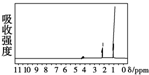 | C. | 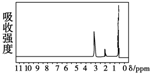 | D. | 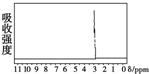 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年中国诺贝尔生理学奖获奖者屠呦呦女士用乙醚从黄花蒿中提取青蒿素,该技术应用了分馏原理 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 生物炼铜原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 近日我国科学家成功制得反应物--超快正电子,正电子与负电子相遇就会湮灭并释放出极大的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取 10.1gNaOH时,将 10g的砝码放在右盘,并将游码移到 0.1g的位置 | |
| B. | 做钠与水反应的实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| C. | 向试管中加入 5mL溴水、2mL苯和 0.5g铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴 | |
| D. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分 别插入石墨棒用导线与电流计相连,然后用装有 K2SO4饱和溶液的琼脂的 U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com