
 µŖ”¢Įņ”¢ĀČ”¢ÄĘ”¢ĀĮ”¢Ģś¼°Ęä»ÆŗĻĪļŹĒŃŠ¾æ»ł±¾øÅÄīŗĶ»ł±¾ĄķĀŪµÄÖŲŅŖŌŲĢ壮
µŖ”¢Įņ”¢ĀČ”¢ÄĘ”¢ĀĮ”¢Ģś¼°Ęä»ÆŗĻĪļŹĒŃŠ¾æ»ł±¾øÅÄīŗĶ»ł±¾ĄķĀŪµÄÖŲŅŖŌŲĢ壮| ŠŌÖŹ | µŚŅ»µēĄėÄÜ | ČŪµć | °ė¾¶ | ¼üÄÜ |
| ¶ŌĻó | S£¼Cl | Na£¼Al | N3-£¾Al3+ | N=N£¼N”ŌN |
·ÖĪö £Ø1£©Ķ¬ÖÜĘŚĖęŌ×ÓŠņŹżŌö“óŌŖĖŲµŚŅ»µēĄėÄܳŹŌö“óĒ÷ŹĘ£¬µ«¢ņA”¢¢õA×åµÄµŚŅ»µēĄėÄÜøßÓŚĶ¬ÖÜĘŚĻąĮŚŌŖĖŲµÄ£»
Ąė×ÓµēŗÉŌ½¶ą”¢Ąė×Ó°ė¾¶Ō½Š”£¬½šŹō¼üŌ½Ē棬½šŹō¾§ĢåµÄČŪµćŌ½øߣ»
µē×Ó²ć½į¹¹ĻąĶ¬µÄĄė×Ó£¬ŗĖµēŗÉŹżŌ½“óĄė×Ó°ė¾¶Ō½Š”£»
Ķ¬ÖÜĘŚŌŖĖŲŠĪ³ÉµÄ¹²¼Ū¼ü£¬Čż¼üµÄ¼üÄÜøßÓŚĖ«¼üµÄ¼üÄÜ£»
£Ø2£©æռ乹ŠĶ³ŹČż½Ē׶ŠĪĖµĆ÷¼Ū²ćµē×Ó¶ŌŹżĪŖ4£¬ŗ¬ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬ÖŠŠÄŌ×ÓĮ¬½ÓŌ×ÓŹżÄæĪŖ3£»
¹Ā¶Ōµē×ÓÖ®¼äÅųā×÷ÓĆ“óÓŚ¹Ā¶Ōµē×ÓÓė³É¼üµē×Ó²ćÖ®¼äµÄÅųā×÷ÓĆ£¬¹Ā¶Ōµē×ÓÓė³É¼üµē×ÓµÄÅųāĮ¦±Č³É¼üµē×ÓÖ®¼äÅųāĮ¦“ó£»
£Ø3£©£ØSCN£©2·Ö×ÓÖŠĆæøöŌ×Ó×īĶā²ć¶¼“ļµ½ĪČ¶Ø½į¹¹£¬Ęä½į¹¹Ź½ĪŖN”ŌC-S-S-C”ŌN£»
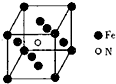
£Ø4£©¢Ł¾§°ūÖŠNŌ×Ó“¦ÓŚĢåŠÄ£¬FeŌ×Ó“¦ÓŚ¶„µćÓėĆęŠÄ£¬ĄūÓĆ¾łĢƷؼĘĖćŌ×ÓŹżÄ棬½ų¶ųČ·¶Ø»ÆѧŹ½£»
¢Ś½įŗĻ¾§°ūÖŠŗ¬ÓŠŌ×ÓŹżÄæ±ķŹ¾³ö¾§°ūÖŹĮ棬ŌŁøł¾Ż¦Ń=$\frac{m}{V}$¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©Ķ¬ÖÜĘŚĖęŌ×ÓŠņŹżŌö“óŌŖĖŲµŚŅ»µēĄėÄܳŹŌö“óĒ÷ŹĘ£¬µ«¢ņA”¢¢õA×åµÄµŚŅ»µēĄėÄÜøßÓŚĶ¬ÖÜĘŚĻąĮŚŌŖĖŲµÄ£¬¹ŹµŚŅ»µēĄėÄÜS£¼Cl£¬
ĀĮĄė×ÓµēŗɶąÄĘĄė×ӵģ¬¶ųĀĮĄė×Ó±Č½ĻŠ”ÓŚÄĘĄė×Ó£¬¹Ź½šŹōAlÖŠ½šŹō¼üøüĒ棬ŌņČŪµćNa£¼Al£¬
µē×Ó²ć½į¹¹ĻąĶ¬µÄĄė×Ó£¬ŗĖµēŗÉŹżŌ½“óĄė×Ó°ė¾¶Ō½Š”£¬¹ŹĄė×Ó°ė¾¶£ŗN3-£¾Al3+£¬
Ķ¬ÖÜĘŚŌŖĖŲŠĪ³ÉµÄ¹²¼Ū¼ü£¬Čż¼üµÄ¼üÄÜøßÓŚĖ«¼üµÄ¼üÄÜ£¬¼“¼üÄÜN=N£¼N”ŌN£¬
¹Ź“š°øĪŖ£ŗ£¼£»£¼£»£¾£»£¼£»
£Ø2£©æռ乹ŠĶ³ŹČż½Ē׶ŠĪĖµĆ÷¼Ū²ćµē×Ó¶ŌŹżĪŖ4£¬ŗ¬ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬ÖŠŠÄŌ×ÓĮ¬½ÓŌ×ÓŹżÄæĪŖ3£¬ŌŚN”¢S”¢ClµÄŗ¬ŃõĖįµÄŅõĄė×ÓÖŠ£¬æռ乹ŠĶ³ŹČż½Ē׶ŠĪµÄÓŠSO32-”¢ClO3-£¬
H2S·Ö×ÓÖŠŗ¬ÓŠ2¶Ō¹Ā¶Ōµē×Ó£¬°±Ęųµē×ÓÖŠŗ¬ÓŠ1¶Ō¹Ā¶Ōµē×Ó£¬¹Ā¶Ōµē×ÓÖ®¼äÅųā×÷ÓĆ“óÓŚ¹Ā¶Ōµē×ÓÓė³É¼üµē×Ó²ćÖ®¼äµÄÅųā×÷ÓĆ£¬ĖłŅŌ¼ü½ĒÓɓ󵽊”ÅÅĮŠµÄĖ³ŠņNH3£¾H2S£¬
¹Ź“š°øĪŖ£ŗSO32-”¢ClO3-£»NH3£»°±Ęųµē×ÓÖŠŗ¬ÓŠ1¶Ō¹Ā¶Ōµē×Ó£¬H2S·Ö×ÓÖŠŗ¬ÓŠ2¶Ō¹Ā¶Ōµē×Ó£¬¹Āµē×Ó¶ŌŌ½¶ą£¬¶Ō³É¼üµē×Ó¶ŌµÄÅųāŌ½“󣬼ü½ĒŌ½Š”£»
£Ø3£©£ØSCN£©2·Ö×ÓÖŠĆæøöŌ×Ó×īĶā²ć¶¼“ļµ½ĪČ¶Ø½į¹¹£¬Ęä½į¹¹Ź½ĪŖN”ŌC-S-S-C”ŌN£¬·Ö×ÓÖŠ¦Ņ¼üŗĶ¦Š¼üŹżÄæÖ®±ČĪŖ5£ŗ4£¬
¹Ź“š°øĪŖ£ŗ5£ŗ4£»
£Ø4£©¢Ł¾§°ūÖŠNŌ×Ó“¦ÓŚĢåŠÄ£¬¾§°ūÖŠŗ¬ÓŠ1øöNŌ×Ó£¬FeŌ×Ó“¦ÓŚ¶„µćÓėĆęŠÄ£¬¾§°ūÖŠFeŌ×ÓŹżÄæĪŖ8”Į$\frac{1}{8}$+6”Į$\frac{1}{2}$=4£¬¹Ź»ÆѧŹ½ĪŖ£ŗFe4N£¬
¹Ź“š°øĪŖ£ŗFe4N£»
¢Ś¾§°ūÖŹĮæĪŖ$\frac{56”Į4+14}{{N}_{A}}$g£¬¾§°ūĢå»żĪŖV cm3£¬øĆ¾§°ūµÄĆܶČĪŖ $\frac{56”Į4+14}{{N}_{A}}$g”ĀV cm3=$\frac{238}{V{N}_{A}}$g•cm-3£¬
¹Ź“š°øĪŖ£ŗ$\frac{238}{V{N}_{A}}$£®
µćĘĄ ±¾ĢāŹĒ¶ŌĪļÖŹ½į¹¹ÓėŠŌÖŹµÄ漲飬Éę¼°µēĄėÄÜ”¢Ī¢Į£°ė¾¶±Č½Ļ”¢ČŪ·Šµć±Č½Ļ”¢æռ乹ŠĶ”¢»Æѧ¼ü”¢¾§°ū¼ĘĖćµČ£¬×¢ŅāĶ¬ÖÜĘŚµŚŅ»µēĄėÄÜŅģ³£Ēéæö£¬ÕĘĪÕ¾łĢƷؽųŠŠÓŠ¹Ų¾§°ū¼ĘĖć£¬Ąķ½āøł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪÅŠ¶Ļ¼ü½ĒĪŹĢā£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖŹĮæŹżĪŖ12 | B£® | ŗĖµēŗÉŹżĪŖ12 | ||
| C£® | µē×ÓŹżĪŖ28 | D£® | ÖŠ×ÓŹżÓėÖŹ×ÓŹżÖ®²īĪŖ16 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹¤ŅµŃĪæÉ“śĢęŹ³ŃĪŹ³ÓĆ | B£® | ¼ÓµāŹ³ŃĪĢķ¼ÓµÄŹĒµāĖį¼Ų | ||
| C£® | Ź³ŃĪŹĒŗīŹĻÖĘ¼īµÄÖ÷ŅŖŌĮĻÖ®Ņ» | D£® | ¹¤ŅµÉĻµē½ā±„ŗĶŹ³ŃĪĖ®æÉÖĘČ”ÉÕ¼ī |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
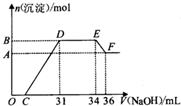 ĻõĖįŌ½Ļ”»¹Ō²śĪļÖŠµŖŌŖĖŲµÄ»ÆŗĻ¼ŪŌ½µĶ£®Ä³Ķ¬Ń§Č”ĢśĀĮŗĻ½šÓė×ćĮæŗÜĻ”µÄĻõĖį³ä·Ö·“ӦƻӊĘųĢå·Å³ö£®ŌŚ·“Ó¦ŗóµÄČÜŅŗÖŠÖšµĪ¼ÓČė4mol•L-1 NaOHČÜŅŗ£¬Ėł¼ÓNaOHČÜŅŗµÄĢå»żÓė²śÉśµÄ³ĮµķµÄĪļÖŹµÄĮæµÄ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ĻõĖįŌ½Ļ”»¹Ō²śĪļÖŠµŖŌŖĖŲµÄ»ÆŗĻ¼ŪŌ½µĶ£®Ä³Ķ¬Ń§Č”ĢśĀĮŗĻ½šÓė×ćĮæŗÜĻ”µÄĻõĖį³ä·Ö·“ӦƻӊĘųĢå·Å³ö£®ŌŚ·“Ó¦ŗóµÄČÜŅŗÖŠÖšµĪ¼ÓČė4mol•L-1 NaOHČÜŅŗ£¬Ėł¼ÓNaOHČÜŅŗµÄĢå»żÓė²śÉśµÄ³ĮµķµÄĪļÖŹµÄĮæµÄ¹ŲĻµČēĶ¼£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | DµćČÜŅŗÖŠ“ęŌŚ£ŗc£ØNH4+£©+c£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØNO3-£© | |
| B£® | EF¶Ī·¢Éś»Æѧ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl£ØOH£©3+OH-=Al£ØOH£©4- | |
| C£® | ŌČÜŅŗÖŠn£ØNH4+£©=0.012mol | |
| D£® | ČÜŅŗÖŠ½įŗĻOH-ÄÜĮ¦×īĒæµÄĄė×ÓŹĒH+£¬×īČõµÄĄė×ÓŹĒAl3+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
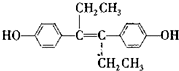 £©ŹĒŅ»ÖÖ¼¤ĖŲĄąŅ©Īļ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
£©ŹĒŅ»ÖÖ¼¤ĖŲĄąŅ©Īļ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | RŹĒ·¼ĻćĢž | B£® | Rŗ¬2ÖÖŗ¬Ńõ¹ŁÄÜĶÅ | ||
| C£® | 1 mol R×ī¶ąÓė1 mol H2¼Ó³É | D£® | RÄÜ·¢Éś¼Ó³É”¢Č”“śŗĶŃõ»Æ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
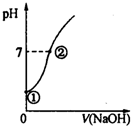 ³£ĪĀĻĀ£¬Ļņ±„ŗĶĀČĖ®ÖŠÖšµĪµĪČė0.10mol•L-1µÄĒāŃõ»ÆÄĘČÜŅŗ£¬ČÜŅŗµÄpH±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©
³£ĪĀĻĀ£¬Ļņ±„ŗĶĀČĖ®ÖŠÖšµĪµĪČė0.10mol•L-1µÄĒāŃõ»ÆÄĘČÜŅŗ£¬ČÜŅŗµÄpH±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | ¢ŁµćĖłŹ¾ČÜŅŗÖŠÖ»“ęŌŚHClOµÄµēĄėĘ½ŗā | |
| B£® | Ė®µÄµēĄė³Ģ¶Č£ŗ¢Ł£¾¢Ś | |
| C£® | I-ŌŚ¢ŚµćĖłŹ¾ČÜŅŗÖŠÄÜĪČ¶Ø“ęŌŚ | |
| D£® | ¢ŚµćĖłŹ¾ČÜŅŗÖŠ£ŗc£ØNa+£©=c£ØCl-£©+c£ØClO-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅĻ©ÓėHBr·¢Éś¼Ó³É·“Ó¦ | B£® | ±½·¢ÉśĻõ»Æ·“Ó¦ | ||
| C£® | ŅŅĻ©ŗĻ³É¾ŪŅŅĻ© | D£® | ŅŅ“¼“ß»ÆŃõ»ÆÉś³ÉŅŅČ© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņĘ·ŗģČÜŅŗÖŠ·Ö±šĶØČėSO2ŗĶCl2£¬Ę·ŗģ¾łĶŹÉ« | |
| B£® | ĻņĮŃ»ÆĘūÓĶŗĶ±½ŅŅĻ©ÖŠ·Ö±š¼ÓČėäåĖ®£¬äåĖ®¾łĶŹÉ« | |
| C£® | ·Ö±š¼ÓČČŹ¢ÓŠĀČ»Æļ§ŗĶµ„ÖŹµāµÄŹŌ¹Ü£¬ÄŚ±Ś»ņ¹ÜæŚ¾łÓŠ¹ĢĢåÄż½į | |
| D£® | ·Ö±šĻņ¼¦µ°°×ČÜŅŗÖŠ¼ÓČė±„ŗĶĮņĖįļ§ČÜŅŗŗĶ¼×Č©ČÜŅŗ£¬¾łÓŠ¹ĢĢåĪö³ö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ×鱚 | KMnO4ČÜŅŗ /ml | H2C2O4ČÜŅŗ /ml | 10%ĮņĖįĢå»ż/mL | ĪĀ¶Č/”ę | ĘäĖūĪļÖŹ |
| ¢ń | 8.00 | 5.00 | 3.00 | 20 | |
| ¢ņ | 8.00 | 5.00 | 3.00 | 30 | |
| ¢ó | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL ÕōĮóĖ® |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com