
 £®
£®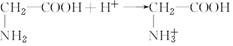 £®
£® ·ÖĪö °±»łŅŅĖįĪŖĮ½ŠŌ»ÆŗĻĪļ£¬ŗ¬ÓŠ°±»ł£¬æÉÓėĖį·“Ó¦£¬ŗ¬ÓŠōČ»ł£¬¾ßÓŠĖįŠŌ£¬æÉÓė¼ī·“Ó¦£¬æÉøł¾ŻĖį¼īÖøŹ¾¼ĮµÄ±ä»ÆÅŠ¶Ļ£¬ŅŌ“Ė½ā“š£®
½ā“š ½ā£ŗ£Ø1£©ŌŚŅ»Ö§ŹŌ¹ÜÖŠ¼ÓČė2mLÕōĮóĖ®£¬ŌŁ¼ÓČė1µĪ¼«Ļ”µÄÉÕ¼īČÜŅŗ£¬ŌŚ“ĖČÜŅŗÖŠ¼ÓČė2µĪ·ÓĢŖŹŌŅŗ£¬“ĖŹ±ČÜŅŗÉŌĻŌ·ŪŗģÉ«£¬Č»ŗó¼ÓČėŅ»Š”Į£°±»łŅŅĖį¾§Ģ壬ČÜŅŗµÄ·ŪŗģÉ«ĶŹČ„£®ĖµĆ÷°±»łŅŅĖįĻŌŹ¾³öĮĖĖįŠŌ£¬·Ö×ÓÖŠÓŠōČ»ł£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ  £¬
£¬
¹Ź“š°øĪŖ£ŗĖį£»ōČ£» £»
£»
£Ø2£©Ķ¬ŃłŌŚŹ¢ÓŠÕōĮóĖ®µÄŹŌ¹ÜÖŠ¼ÓČė×ĻÉ«ŹÆČļŹŌŅŗ¼°1µĪĻ”ŃĪĖį£¬Ź¹ČÜŅŗÉŌĻŌŗģÉ«£¬Č»ŗó¼ÓČėŅ»Š”Į£°±»łŅŅĖį¾§Ģ壬ČÜŅŗÓÉŗģÉ«×Ŗ±äĪŖ×ĻÉ«£¬ĖµĆ÷ĮĖ°±»łŅŅĖįĻŌŹ¾³öĮĖ¼īŠŌ£¬·Ö×ÓÖŠÓŠ°±»ł£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ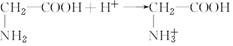 £¬
£¬
¹Ź“š°øĪŖ£ŗ¼ī£»°±£»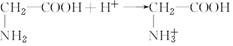 £®
£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄ½į¹¹ŗĶŠŌÖŹ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬עŅā°ŃĪÕÓŠ»śĪļµÄ½į¹¹ŅŌ¼°·“Ó¦µÄĻÖĻóµÄ·ÖĪöŗĶÅŠ¶Ļ£¬ÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ĪļÖŹ | ČŪµć/”ę | ·Šµć/”ę | ĘäĖüŠŌÖŹ |
| SO2Cl2 | -54.1 | 69.1 | ¢ŁŅ×ÓėĖ®·“Ó¦£¬²śÉś“óĮæ°×Īķ ¢ŚŅ×·Ö½ā£ŗSO2Cl2$\frac{\underline{\;100”ę\;}}{\;}$SO2”ü+Cl2”ü |
| H2SO4 | 10.4 | 338 | ĪüĖ®ŠŌĒŅ²»Ņ×·Ö½ā |
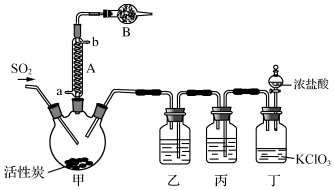
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆĶŠÅĢĢģĘ½³ĘČ”5.85gNaCl | |
| B£® | ÓĆ¹ć·ŗpHŹŌÖ½²āµĆ³ČÖpHĪŖ3.50 | |
| C£® | ÓĆĖįŹ½µĪ¶Ø¹ÜĮæČ”25.00 mLøßĆĢĖį¼ŲČÜŅŗ | |
| D£® | ÓĆĖįŠŌøßĆĢĖį¼ŲČÜŅŗ¼ģŃéFeCl3ÖŠŹĒ·ńŗ¬ÓŠFeC12 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żŃõ»ÆÄʵĵē×ÓŹ½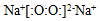 | |
| B£® | CO2µÄµē×ÓŹ½£ŗ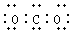 | |
| C£® | ${\;}_{53}^{127}$IŗĶ${\;}_{53}^{129}$I2»„ĪŖĶ¬Ī»ĖŲ | |
| D£® | ĮņĄė×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ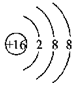 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.012kg12CĖłŗ¬µÄĢ¼Ō×ÓŹż¾ĶŹĒ°¢·üŁ¤µĀĀŽ³£Źż | |
| B£® | µČÖŹĮæµÄO2ŗĶO3ÖŠĖłŗ¬ŃõŌ×ÓµÄĪļÖŹµÄĮæĻąĶ¬ | |
| C£® | µČĪļÖŹµÄĮæµÄ·Ö×ÓĖłŗ¬Ō×ÓŹżÄæŅ»¶ØĻąµČ | |
| D£® | ±ź×¼×“æöĻĀ£¬1molH2µÄĢå»żŌ¼ĪŖ22.4L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ōö“ó·“Ó¦ĪļÅضČÄÜŌö“óÓŠŠ§ÅöײµÄ¼øĀŹ | |
| B£® | Ōö¼ÓŃ¹ĒæÄÜŌö“ó·“Ó¦Īļ»ī»Æ·Ö×ӵİŁ·ÖŹż | |
| C£® | Ōö¼Ó·“Ó¦ĪļÅضČÄÜŌö“ó·“Ó¦Īļ»ī»Æ·Ö×ӵİŁ·ÖŹż | |
| D£® | ·Ö½ā·“Ó¦¶¼ŹĒĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żŃõ»ÆÄĘÓėĖ®·“Ó¦Ź±£¬Éś³É0.1molŃõĘų×ŖŅʵĵē×ÓŹżĪŖ0.2NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀµÄ67.2LĀČĘųÓė27gĀĮ³ä·Ö·“Ó¦£¬×ŖŅʵē×ÓŹżĪŖ3NA | |
| C£® | 1L 1mol/LµÄĻ”ĻõĖįÖŠ£¬ŗ¬ŃõŌ×ÓŹżĪŖ3NA | |
| D£® | 1molCOŗĶCO2»ģŗĻĘųĢåÖŠŗ¬CŌ×ÓŹżĪŖNA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com