
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
分析 ①反应热的大小与物质的量成正比;
②2H2O(l)=2H2(g)+O2(g)分解反应是吸热反应,所以△H1>0,而活泼金属与水的反应是放热反应,所以△H2<0;
③气态的甲醇转化为液态的甲醇要放热,结合盖斯定律分析解答;
④合成氨正反应是气体体积减小的反应,所以恒压达平衡时的体积小于恒容的体积;
解答 解:①反应热的大小与物质的量成正比,所以物质的量越多放出的热量越多,值越小,则△H1<△H2,故错误;
②2H2O(l)=2H2(g)+O2(g)分解反应是吸热反应,所以△H1>0,而活泼金属与水的反应是放热反应,所以△H2<0,所以;△H1>△H2,故正确;
③气态的甲醇转化为液态的甲醇要放热,由反应Ⅰ、CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1;ⅡCH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H2;根据盖斯定律Ⅰ-Ⅱ得:CH3OH(g)=CH3OH(l),△H1-△H2<0,所以△H1<△H2,故正确;
④合成氨正反应是气体体积减小的反应,所以恒压达平衡时的体积小于恒容的体积,所以恒容相当于在恒压的基础上减小压强,平衡逆向移动,则恒容放出的热量少,所以Q1<Q2,故正确;
故选C.
点评 本题考查反应热焓变的含义,侧重于热化学方程式意义的分析,注意反应热大小与反应物的物质的量成正比,难度不大,比较基础.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
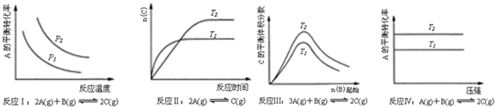
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平 | B. | 胶头滴管 | C. | 250 mL容量瓶 | D. | 量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶解在稀HCl中 CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2 Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应 H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com