
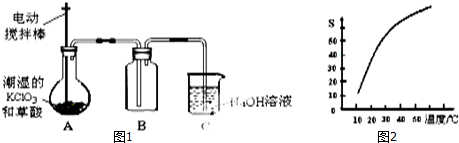

���� ��1��Bװ�������ռ�ClO2����ClO2�۵�ͣ�Ӧ����ˮ��ȴ�ռ���
��2��NaClO2�ܽ�����¶�Ӱ������¶ȸ���38��ʱ����������NaClO2������Һ�л��NaClO2���壬��Ҫ�����ᾧ�����Ȼ�38�����Ϲ��ˡ�ϴ�ӡ�����õ���
��3����������ͼ��֪���������Ӹ�Ĥ���أ������������Һ�����ǵ��ˮ������a����ҺA��ͬһ�缫�õ���NaOH������b������缫�õ�����AΪ���ᣬaΪ������bΪ������I��NaClO3��Na2SO3�����ᷴӦ����C1O2��Na2SO4��Һ����Ӧ���ӷ���ʽΪ��2H++SO32-+2ClO3-=2C1O2+SO42-+H2O������C1O2����������ڼ��������·�Ӧ����NaClO2��������
��ClO2�����������ƺ�ϡ����Ϊԭ���Ʊ������ݵ���ת���غ㣬��֪����NaCl���ɣ�
�۷�����Ӧ��3NaClO2=2NaClO3+NaCl��3molNaClO2���ʵõ�2mol NaClO3��������FeSO4��Һ��Ӧʱ��NaClO2��NaClO3����Fe2+��ԭΪCl-������3molNaClO2��2mol NaClO3��Ӧ��õ�����Ŀ��
��� �⣺��1��Bװ���ռ�ClO2�����۵�ͣ�Ӧ����ˮ��ȴ�ռ���ʹClO2������������ٻӷ���
�ʴ�Ϊ��ʹClO2������������ٻӷ���
��2��NaClO2�ܽ�����¶�Ӱ������¶ȸ���38��ʱ����������NaClO2������Һ�л��NaClO2���壬��Ҫ�����ᾧ�����Ȼ�38�����Ϲ��ˡ�ϴ�ӡ�����õ���
�ʴ�Ϊ�������ᾧ�����ȹ��ˣ�
��3����������ͼ��֪���������Ӹ�Ĥ���أ������������Һ�����ǵ��ˮ������a����ҺA��ͬһ�缫�õ���NaOH������b������缫�õ�����AΪ���ᣬaΪ������bΪ������I��NaClO3��Na2SO3�����ᷴӦ����C1O2��Na2SO4��Һ����Ӧ���ӷ���ʽΪ��2H++SO32-+2ClO3-=2C1O2+SO42-+H2O������C1O2����������ڼ��������·�Ӧ����NaClO2�����������з�Ӧ���ӷ���ʽΪ��2ClO2+H2O2+2OH-=2ClO2-+O2��+2H2O��
�ʴ�Ϊ��2ClO2+H2O2+2OH-=2ClO2-+O2��+2H2O��
��ClO2�����������ƺ�ϡ����Ϊԭ���Ʊ������ݵ���ת���غ㣬��֪����NaCl���ɣ���Ӧ����ʽΪ��5NaClO2+4HCl=5NaCl+4ClO2��+2H2O��
�ʴ�Ϊ��5NaClO2+4HCl=5NaCl+4ClO2��+2H2O��
�۷�����Ӧ��3NaClO2=2NaClO3+NaCl��3molNaClO2���ʵõ�2mol NaClO3��������FeSO4��Һ��Ӧʱ��NaClO2��NaClO3����Fe2+��ԭΪCl-��3molNaClO2��Ӧ��õ���Ϊ3mol��4=12mol��2mol NaClO3��Ӧ��õ���Ϊ2mol��6-12mol��������Fe2+���ʵ�����ͬ��
�ʴ�Ϊ����ͬ��
���� ���⿼�������Ʊ�ʵ�鷽������ƣ���Ŀ�Ѷ��еȣ����ض��Ʊ�ԭ�������ʵķ����ᴿ�Ŀ��飬�ϺõĿ���ѧ���������⡢����������������ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ڵ�����ˮ����μ���FeCl3������Һ����Һ������ĺ��ɫ�����Ƶ������������� | |
| B�� | �۲���һ���мƻ�����Ŀ�ĵ��øйٿ����о�����ķ��� | |
| C�� | �ڶ����м�����±���������õ��ǽ���۳���ԭ�� | |
| D�� | �о��������ʵ�һ�����ĵ�һ����Ԥ�����ʵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
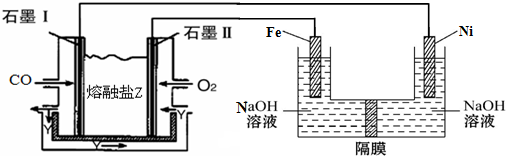
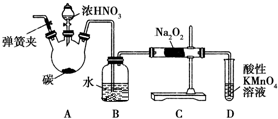 �������ƣ�NaNO2������Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺����ľ̿��Ũ���ᡢˮ��ͭΪԭ���Ʊ��������Ƶ�װ����ͼ��ʾ����֪�������£���2NO+Na2O2�T2NaNO2����3NaNO2+3HCl�T3NaCl+HNO3+2NO��+H2O�������������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+��
�������ƣ�NaNO2������Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺����ľ̿��Ũ���ᡢˮ��ͭΪԭ���Ʊ��������Ƶ�װ����ͼ��ʾ����֪�������£���2NO+Na2O2�T2NaNO2����3NaNO2+3HCl�T3NaCl+HNO3+2NO��+H2O�������������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺
�������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺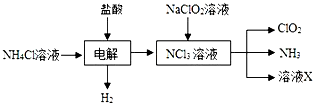
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ⷨ����ͭʱ���Դ�ͭ����������ͭ������ | |
| B�� | SiO2��s��+2C��s��=Si��s��+2CO��g���ڳ����²����Է����У���÷�Ӧ�ġ�H��0 | |
| C�� | �����£�NH4Cl��Һ��ˮϡ�ͣ�$\frac{{c��N{H_3}•{H_2}O��•c��{H^+}��}}{{c��N{H_4}^+��}}$���� | |
| D�� | C��s��+H2O��g��?CO��g��+H2��g������H��0����������������ʱ�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com