
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
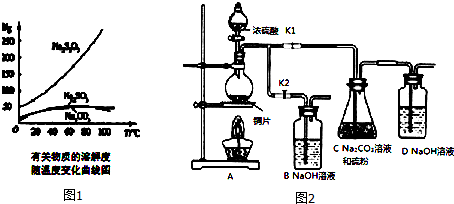
分析 (1)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(2)Na2S2O3在酸性溶液中不能稳定存在,二氧化硫通入碳酸钠溶液中反应生成亚硫酸钠和硫粉反应生成硫代硫酸钠;停止C装置反应打开K2,关闭K1;
(3)依据过滤装置需要的玻璃仪器分析判断;从溶液中获得Na2S2O3•5H2O晶体,需要经过加热浓缩、冷却结晶、过滤、洗涤、烘干等步骤;
(4)以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,终点现象为溶液变蓝色且半分钟内不褪色;
(5)依据反应的定量关系 2S2O32-+I2→S4O62-+2I-.计算碘单质消耗的硫代硫酸钠,计算得到样品中的质量分数.
解答 解:(1)浓硫酸具有强氧化性,在加热的条件下能氧化单质铜,反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,所以C中碳酸钠的作用是起反应物作用及提供碱性环境,“停止C中的反应”的操作是打开K2,关闭K1,
故答案为:Na2S2O3在酸性溶液中不能稳定存在;打开K2,关闭K1;
(3)过滤时的主要玻璃仪器有漏斗、烧杯、玻璃棒,从溶液中获得Na2S2O3•5H2O晶体,需要经过加热浓缩、冷却结晶、过滤、洗涤、烘干等步骤,
故答案为:漏斗、玻璃棒;加热浓缩、冷却结晶;
(4)由于碘遇淀粉显蓝色,则滴定时,达到滴定终点的现象是溶液变蓝,且半分钟不改变,
故答案为:加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变;
(5)根据表中数据可知,第3次实验中消耗I2标准溶液的体积偏小,舍去,则实际消耗I2标准溶液的体积的平均值是$\frac{19.99+19.98+20.03}{3}$mL=20.0mL,则根据反应的方程式可知,Na2S2O3•5H2O的物质的量是0.050mol/L×0.0200L×2×10=0.02mol,所以Na2S2O3•5H2O在产品中的质量分数是$\frac{0.02mol×248g/mol}{5.5g}$=90.2%,
故答案为:90.2%.
点评 本题考查了物质性质的实验验证和实验方法应用,物质性质的掌握和实验基本操作是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若电极材料均为石墨,当析出6.4g Cu时,两池共产生气体3.36L(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0176 | B. | 0.1600 | C. | 0.1200 | D. | 0.2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com