
分析 (1)根据酚酞的变色范围是8~10,溶液显弱碱性,此时BaCO3不溶解;
(2)根据滴定管下方刻度线距活塞处有一定的空间,不能测出其所用的滴定液的体积;
(3)根据甲基橙的变色范围是3.1~4.4,此时BaCO3溶解,HCl不仅与NaoH发生反应,还会与BaCO3反应.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,判断不当操作对V(标准)影响,从而判断对浓度的影响.
解答 解:(1)根据酚酞的变色范围是8~10,此时BaCO3不溶解,HCl只与NaoH发生反应,不会与BaCO3反应,不会影响NaOH的含量的测定;
故答案为:用酚酞作指示剂,滴定终点pH>7,碳酸钡不能溶解;
(2)因为滴定管下方刻度线距活塞处有一定的空间,所以若滴定管中滴定液一直下降到活塞处才到达滴定终点,不能测出其所用的滴定液的体积;
故答案为:不能;因为滴定管下方刻度线距活塞处有一定的空间,不能测出其所用的滴定液的体积;
(3)因为甲基橙的变色范围是3.1~4.4,此时BaCO3溶解,HCl不仅与NaOH发生反应,还会与BaCO3反应,所以不能改用甲基橙作指示剂,若使用甲基橙作指示剂,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,则测定结果偏高;
故答案为:不能;偏高.
点评 本题主要考查了中的滴定操作,注意指示剂对测定结果的影响以及误差分析,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量碳酸钠晶体(Na2CO3•10H2O)的时间太长,而且暴露在空气中 | |
| B. | 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤 | |
| C. | 定容时仰视刻度线 | |
| D. | 溶解后未冷却到室温,立即转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
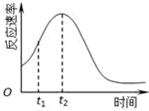 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
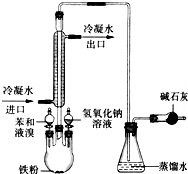 如图是实验室制取溴苯的装置图.
如图是实验室制取溴苯的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 往待测液中滴加硝酸银溶液 | 有白色沉淀出现 | 待测液中含有Cl- |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体分子的数目和分子本身的大小 | |
| B. | 气体分子的质量和分子本身的大小 | |
| C. | 气体分子本身的大小和分子间的平均距离 | |
| D. | 气体分子的数目和分子间的平均距离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为5NA | |
| C. | 1 mol甲基的电子数目为7NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其所含原子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com