
| �� �� �� | �� | 0 | ||||||
| 1 | �� | �� | �� | �� | �� | �� | �� | |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� |
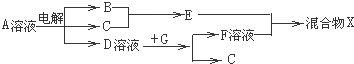
| ||
| ||
| 1 |
| 2 |
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CaO+H2O�TCa��OH��2 | ||||
| B��Zn+2HCl�TZnCl2+H2�� | ||||
C��2NaCl+2H2O
| ||||
| D��NaCl+AgNO3�TAgCl��+NaNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ʱ������ȷ����Һ����̶������� |
| B������ƿʹ��ǰ������ˮ��ϴ��������������ˮ |
| C�����ݺ������ƿ�ߵ�ҡ�ȣ�����Һ����ڿ̶��ߣ��ֲ�������ȱ��ˮ |
| D�����ƹ����У�������ˮϴ���ձ��Ͳ�������δ��ϴ��Һ��������ƿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
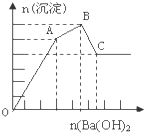 ��FeCl3��Al2��SO4��3�Ļ����Һ����μ���Ba��OH��2��aq�����γɳ����������ͼ��ʾ���������������ܽ��pH�����±��������ƶϴ�����ǣ�������
��FeCl3��Al2��SO4��3�Ļ����Һ����μ���Ba��OH��2��aq�����γɳ����������ͼ��ʾ���������������ܽ��pH�����±��������ƶϴ�����ǣ������� | �������� | ��ҺPH | |||
| ��ʼ���� | ������ȫ | ������ʼ�ܽ� | ������ȫ�ܽ� | |
| Fe��OH��2 | 2.3 | 3.4 | - | - |
| Al��OH��2 | 3.3 | 5.2 | 7.8 | 12.8 |
| A��C��ij�����Fe��OH��3�� BaSO4 |
| B��OA�ο��ܷ����ķ�Ӧ�У�3Ba2++6OH-+3SO42-+Al3++Fe3+��3BaSO4��+Fe��OH��3��+Al��OH��3�� |
| C��AB�ο��ܷ����ķ�Ӧ�ǣ�2SO42-+2Ba2++Al3++3OH-��2BaSO4��+Al��OH��3�� |
| D����ͼ����ԭ��Һ��c��Cl-��=c��SO42-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1 mol?L-1��CH3COOH��Һ�У���ˮ�����[H+]Ϊ10-13mol?L-1 |
| B��pH=2��pH=1��CH3COOH��Һ��[H+]֮��Ϊ1��10 |
| C��pH=12��NaOH��Һ��pH=2��CH3COOH��Һ�������ϣ���Ϻ���ҺpH��7 |
| D��1 mol��������к��й��ۼ��ĸ���Ϊ8NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com