
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示:
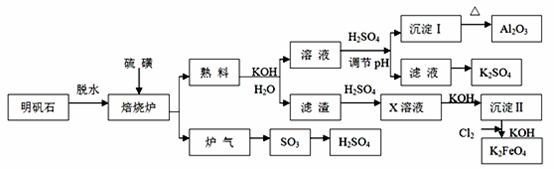
(1)“焙烧”过程中Al2(SO4)3和S发生反应的化学方程式为 ;
若生成102g Al2O3,转移的电子数目为 ;
(2)生成沉淀Ⅰ时的离子方程式为 ;
(3)写出化学式:沉淀Ⅱ是 ;
(4)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 ;
(5)从滤液中得到K2SO4晶体的方法是 ;
(6)K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式为 。
科目:高中化学 来源: 题型:
(1)通过点燃的方法可以鉴别聚乙烯和聚氯乙烯。如果塑料点燃时有强烈的刺激性气味,这种塑料可能是由 制成的。
(2)某同学设计了如图所示实验来验证塑料燃烧的产物。
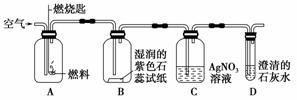
若A瓶燃烧的是聚氯乙烯塑料,在B瓶中可以看到的现象是________________________________________________________________________,
C、D两瓶中发生反应的化学方 程式为____
程式为____ ____________________________________________________________________。
____________________________________________________________________。
若A瓶中 用的是聚乙烯塑料,则在C瓶中 (“能”或“不能”)观察到沉淀。
用的是聚乙烯塑料,则在C瓶中 (“能”或“不能”)观察到沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
A.常温下,Ag2SO4、AgCl、AgI在水中的溶解能力依次减弱
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g) CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)

② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是: 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4)= v逆(H2)如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH = 。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是: 、 、能连续工作。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是短周期元素,其部分性质如下表,下列说法正确的是
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | Y+与NH4+的质子数、电子数均相等 |
| Z | 第三周期原子半径最小的金属 |
A.Z的氧化物属于碱性氧化物 B.离子半径:Z>W
C.最高价氧化物对应水化物的碱性:Y>Z D.气态氢化物的热稳定性:X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物G的合成路线如下:
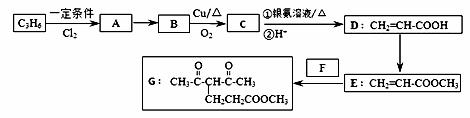
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2 。
(2)除掉E中含有少量D的试剂和分离方法分别是 , ;
(3)下列说法正确的是 (填字母序号)。
a.A易溶于水
b.只用溴水即可确定C中含有碳碳双键
c.E经加聚、碱性条件下水解,所得高聚物可做具有高吸水性能的树脂
d.E是CH2=CHCOOCH2CH3的同系物
(4)写出A→B的化学反应方程式 ;
写出C和银氨溶液反应的离子方程式 。
(5)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。
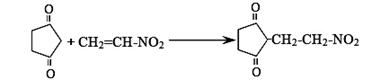

(6)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是( )
A.有机物一定含有碳元素,所以含碳元素的化合物一定是有机物
B.置换反应一定生成一种
C.含碳元素的物质在O2中充分燃烧会生成CO2,所以在O2中燃烧能生成CO2的物质一定含碳元素
D.盐的组成中含有金属阳离子与酸根离子,所以盐中一定不含氢元素
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述中不正确的是
H++CH3COO-,下列叙述中不正确的是
( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的六份溶液:
①0.01 mol·L-1CH3COOH溶液;
②0.01 mol·L-1HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (填序号,下同),水的电离程度相同的是 ;
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(填“>”“<”或“=”);
(3)将六份溶液同等稀释10倍后,溶液的pH:
① ②,③ ④,⑤ ⑥(填“>”“<”或“=”);
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈 (填序号)。
A.酸性 B.碱性 C.中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com