
| A. | MgSO4=Mg2++SO42- | B. | Ba(OH)2=Ba2++OH2- | ||
| C. | NaHCO3=Na++HCO3- | D. | H2SO4=2H++SO42- |
分析 书写电解质电离方程式关键在与分清电解质强弱及电离方式,强电解质完全电离,用等号,弱电解质部分电离,用可逆号,弱酸的酸式根离子不能拆,多元弱酸分步电离,以第一步为主.
解答 解:A.硫酸镁强电解质,完全电离,电离方程式:MgSO4=Mg2++SO42-,故A正确;
B.氢氧化钡为强电解质,完全电离,电离方程式:Ba(OH)2=Ba2++2OH-,故B错误;
C.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++HCO3-,故C正确;
D.硫酸为强电解质,完全电离,电离方程式:H2SO4=2H++SO42-,故D正确;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意电解质电离方程式遵循电荷守恒、原子个数守恒,注意离子符合的书写规范.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | 4NH3+6NO═5N2+6H2O | D. | HCl+NH3═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅和钠 | B. | 硼和氮 | C. | 碳和氯 | D. | 碳和铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打雷闪电时,大气中产生了NO | |
| B. | 豆科植物的根瘤菌把空气中的氮气转化为硝酸盐等含氮化合物 | |
| C. | N2和H2在一定条件下反应生成NH3 | |
| D. | NH3经催化氧化生成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、次氯酸钠、氯水 | B. | 木炭、二氧化硫、冰和水 | ||
| C. | 水银、氧化镁、氢氧化铁胶体 | D. | 钠、氧化钙、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
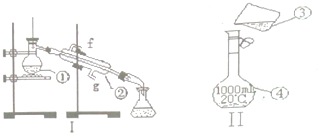
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH3•H2O+H+.
NH3•H2O+H+.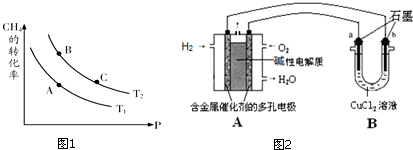
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com