
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2═NO3-+NO↑+H2O | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O+2OH-═2AlO2-+H2O |
分析 A.电解熔融氯化钠生成的钠和氯气;
B.水垢的主要成分为碳酸钙,碳酸钙为难溶物,不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.氧化铝为氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:A.用惰性电极电解熔融氯化钠,反应生成金属Na和氯气,正确的反应为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2Na,故A错误;
B.碳酸钙和醋酸都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.用稀氢氧化钠溶液吸收二氧化氮,反应生成硝酸钠、NO气体和水,正确的离子方程式为:2OH-+3NO2═2NO3-+NO↑+H2O,故C错误;
D.用氢氧化钠溶液除去铝表面的氧化膜,反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
 我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )
我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )| A. | 放电时,Na+由钠箔端向多壁碳纳米管端移动 | |
| B. | 放电时,正极的电极反应为:3CO2+4Na++4e-═2Na2CO3+C | |
| C. | 该电池不宜在高温下使用 | |
| D. | 充电时,钠箔与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

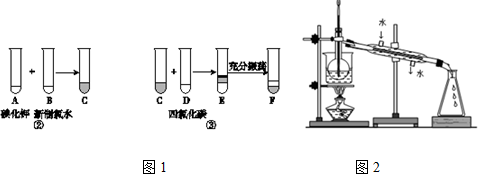
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
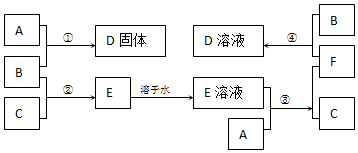
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和铝 | B. | 硅和钠 | C. | 硼和氮 | D. | 氯和碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com